Maladies rares
Pour chacune des maladies vasculaires rares du cerveau ou de l’œil rattachées au centre de référence CERVCO, vous trouverez ci-dessous des documents d’information concernant les caractéristiques de la maladie et sa prise en charge.
Pour chacune des maladies vasculaires rares du cerveau ou de l’œil rattachées au centre de référence CERVCO, vous trouverez ci-dessous des documents d’information concernant les caractéristiques de la maladie et sa prise en charge.
CADASIL est l’acronyme de « Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leukoencephalopathy », soit artériopathie cérébrale autosomique dominante avec infarctus sous-corticaux et leucoencéphalopathie. Il s’agit d’une maladie génétique, à transmission autosomique dominante. Les manifestations cliniques classiques de CADASIL associent des crises de migraine avec aura débutant entre 20 et 40 ans, des infarctus cérébraux survenant habituellement vers cinquante ans et des troubles cognitifs qui deviennent perceptibles entre 50 et 60 ans et s’aggravent progressivement pour aboutir à une démence associée à des troubles moteurs et de l’équilibre à la phase terminale de la maladie. Les troubles de l’humeur (épisodes dépressifs, parfois accès maniaques, ou mélancoliques) sont fréquents. Le profil évolutif de la maladie CADASIL est cependant extrêmement variable, certains patients ne présentent que peu de symptômes, des manifestations espacées dans le temps ou à début tardif, d’autres à l’inverse développent rapidement un handicap grave.
L’IRM (imagerie par résonance magnétique), met en évidence des hypersignaux de la substance blanche, des infarctus de petite taille (infarctus lacunaires) et parfois des micro-saignements. Certains aspects neuroradiologiques sont très évocateurs de la maladie CADASIL, notamment la mise en évidence d’hypersignaux des pôles antérieurs des lobes temporaux du cerveau sur les séquences pondérées T2 ou FLAIR.
Le gène responsable (Notch 3) est localisé sur le bras court du chromosome 19. La protéine du gène Notch 3 est une récepteur membranaire exprimée au niveau des cellules musculaires lisses de la paroi des vaisseaux de petit calibre de tout l’organisme et en particulier du cerveau. Les mutations du gène aboutissent à une accumulation de cette protéine au niveau de la paroi du vaisseau. Le diagnostic fortement suspecté sur les données cliniques et neuroradiologiques est confirmé par la recherche de mutations du gène Notch 3 par un test génétique permettant d’assurer le diagnostic dans près de 100% des cas.
Aucun traitement spécifique de la maladie CADASIL n’a été jusqu’à ce jour évalué mais une prise en charge des symptômes et un soutien psychologique s’avère toujours nécessaire.
CADASIL (Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leukoencephalopathy ou artériopathie cérébrale autosomique dominante avec infarctus sous-corticaux et leucoencéphalopathie) est une maladie héréditaire autosomique dominante touchant les petites artères cérébrales, responsable d’infarctus sous-corticaux et d’une atteinte de la substance blanche (leucoencéphalopathie), due à différentes mutations du gène NOTCH 3 localisé sur le chromosome 19.
D’abord décrite en Europe, la maladie a été maintenant observée dans des familles d’origine ethnique très différente, sur tous les continents. On dénombre actuellement plus de quatre cents familles en Europe. Il n’existe pas encore de véritable étude épidémiologique consacrée à CADASIL en France. Les auteurs d’une étude réalisée dans l’ouest de l’Ecosse en 2002 ont dénombré 22 patients atteints de CADASIL issus de sept familles au sein d’une population de 1.418.990 habitants. En considérant également les apparentés de ces patients, à risque d’être porteur du gène muté, ils ont estimé la prévalence à 4.15/100.000 habitants. La fréquence de la maladie est cependant encore probablement sous-estimée.
Les premières manifestations cliniques, observées chez 1/3 des patients, sont la survenue de crises de migraine avec aura débutant le plus souvent avant 45 ans et s’améliorant avec l’âge. Les accidents vasculaires (AVC) ischémiques (infarctus cérébraux) sont observés chez 60 % des patients le plus souvent aux alentours de cinquante ans. On note également des troubles cognitifs (troubles de la concentration, de l’attention, troubles de la mémoire), d’importance variable: présents très tôt dans l’évolution de la maladie, ils sont rarement handicapants avant l’âge de 50 ans. Ces troubles cognitifs peuvent être à l’origine d’une altération de la vie sociale et aboutir à une démence à la phase terminale de la maladie. Environ 20% des patients de plus de 55 ans sont concernés. La survenue de troubles de la marche et de l’équilibre est également fréquente et concerne la moitié des patients de plus de 55 ans. On retrouve également, dans 10 à 20% des cas des épisodes de troubles psychiatriques et dans 5 à 10 % des cas une comitialité (des crises épileptiques).
Les crises de migraine avec aura (crises de migraine accompagnées de signes neurologiques) sont rapportées par un patient sur trois. La fréquence des crises est extrêmement variable, de deux épisodes par semaine à un tous les 3 ou 4 ans. Les symptômes de l’aura sont, par ordre de fréquence, visuels, sensitifs, aphasiques ou moteurs. L’aura visuelle se manifeste sous des formes variables : il s’agit le plus fréquemment d’un scotome scintillant, moins souvent d’une vision brouillée ou d’une hémianopsie latérale homonyme. Les troubles de la parole au cours des crises de migraine avec aura se résument souvent à des difficultés d’expression avec une réduction de la fluence verbale.
Plus de la moitié des patients CADASIL présentent des crises avec des auras atypiques : crises avec aura à début brutal par exemple, crises de migraine « basilaire » ou crises de migraine « hémiplégique ». Dans quelques cas, des crises extrêmement sévères comme celles observées au cours de la migraine hémiplégique familiale, sont observées à l’origine d’épisodes avec confusion, troubles de la vigilance, coma, hyperthermie pouvant durer plusieurs heures, parfois plusieurs jours.
Environ, 60% des patients rapportent la survenue d’un accident ischémique cérébral transitoire (déficit neurologique régressant en moins de 24h) ou constitué (déficit neurologique permanent) durant l’évolution de la maladie. Il s’agit le plus souvent de manifestations en rapport avec un infarctus de petite taille au niveau du cerveau, à l’origine de manifestations classiques (syndrome lacunaires dues à l’occlusion d’une petite artère: déficit sensitif pur, déficit moteur pur ou déficit sensitivomoteur d’un hémicorps ou hémiparésie ataxie). Ces infarctus cérébraux peuvent survenir en l’absence de tout facteur de risque vasculaire habituel (hypertension artérielle, diabète, hypercholestérolémie).
Les troubles de l’humeur sont observés chez un patient sur cinq. Ils peuvent être inauguraux (jusqu’à 10 % des patients) et conduire à une erreur ou un retard diagnostique. Certains patients présentent des symptômes dépressifs sévères évoquant une mélancolie, qui alterne rarement avec des épisodes maniaques (pouvant faire envisager le diagnostic de trouble bipolaire). L’apathie (perte des motivations) est un signe fréquent de la maladie en rapport avec la localisation des lésions au niveau cérébral. Elle n’est pas toujours secondaire à la dépression.
Les troubles cognitifs (troubles des fonctions exécutives, troubles de l’attention, troubles de la mémoire) sont extrêmement fréquents mais de sévérité très variable au cours de la maladie CADASIL. L’altération des fonctions exécutives (tâches de planification, d’anticipation, d’ajustement, d’autocorrection et de souplesse mentale) est la plus fréquemment et précocement observée et peut être difficilement perceptible de nombreuses années compte tenu du retentissement le plus souvent minime ou absent dans la vie quotidienne. L’atteinte des fonctions exécutives est fréquemment associée à des troubles de l’attention et de la mémoire de travail. Progressivement, avec l’âge, le déclin peut devenir plus sévère avec l’apparition d’une apathie souvent au premier plan et de déficits des fonctions instrumentales (retentissant sur des tâches telles que le dessin, l’écriture) en faveur d’une atteinte cérébrale diffuse. On ne retrouve cependant que rarement une aphasie sévère (troubles du langage), une apraxie (trouble du comportement gestuel volontaire) ou encore une agnosie (trouble de la reconnaissance des objets, des personnes ou lieux dans trouble visuel) fréquemment observés au cours de la maladie d’Alzheimer. La mémoire sémantique (en rapport avec les connaissances) et la reconnaissance sont souvent préservées. Le déclin cognitif apparaît le plus souvent progressivement, le plus souvent en l’absence d’évènements ischémiques, cette évolution peut ainsi évoquer une maladie dégénérative. Parfois, l’aggravation se fait de façon brutale ou par à-coups.
La démence (trouble cognitif retentissant sur la vie du sujet et conduisant à une perte d’autonomie) est observée chez 20% des patients âgés de plus de 55 ans. Elle est fréquemment associée à d’autres signes de gravité de la maladie : troubles de la marche, incontinence urinaire et parfois à un syndrome pseudo-bulbaire (troubles de la déglutition, rire ou pleurer spasmodiques).
L’expression clinique diffère en partie en fonction du sexe. Les femmes sont plus concernées par la survenue de crises de migraine avec aura alors que les hommes ont plus souvent des infarctus cérébraux. Le niveau d’éducation, lorsqu’il est élevé, est associé à une prévalence d’AVC diminuée et à de meilleurs scores cognitifs.
Enfin, malgré l’atteinte diffuse des petites artères de tous les organes, les manifestations de la maladie CADASIL sont exclusivement cérébrales.
Le profil évolutif classique de la maladie se caractérise par l’apparition de crises de migraine avec aura au cours de la troisième décennie, par la survenue d’accidents ischémiques cérébraux transitoires ou constitués, une dizaine d’années plus tard, et par l’installation progressive des troubles cognitifs, de troubles de l’équilibre et de la marche vers la soixantaine. La perte d’autonomie, le handicap moteur et cognitif sont fréquents après 70 ans (Figure 1)
Ce profil évolutif est cependant très inconstant en raison de la grande variabilité évolutive de la maladie qui peut être observée entre parfois plusieurs membres d’une même famille (avec donc la même anomalie génétique). Ainsi, dans certains cas, la maladie peut être à l’origine d’un handicap précoce vers l’âge de 40 ans. A l’inverse, les premières manifestations de la maladie peuvent apparaître après l’âge de 60 ans et rester minimes chez d’autres individus.
Enfin, la survenue d’un accident ischémique cérébral n’est pas un facteur pronostic essentiel à lui seul. La progression de la symptomatologie neurologique est avant tout progressive et s’accélère à partir d’un certain seuil de lacunes et d’atrophie cérébrale.
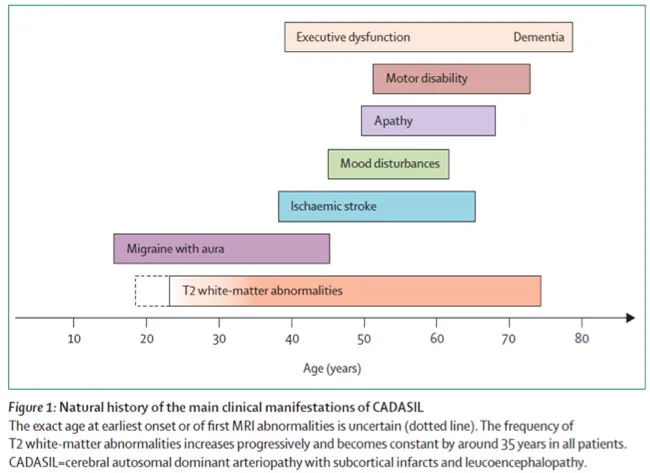
Figure 1: Histoire naturelle résumée de la maladie (source: Lancet Neurol 2009; 8: 643–53)
L’imagerie par résonance magnétique (IRM) est essentielle au diagnostic de la maladie. Les anomalies de signal en IRM (anomalies de la substance blanche cérébrale) sont parfois détectées avant la survenue des premiers symptômes de la maladie. Ces anomalies apparaissent entre l’âge de 20 et 35 ans et peuvent donc être encore inconstantes dans cette tranche d’âge. Par contre, après l’âge de35 ans, tous les sujets porteurs du gène muté, avec ou sans symptôme, ont des anomalies IRM évocatrices de la maladie. Leur absence totale après l’âge de 35 ans doit donc faire remettre en question le diagnostic.
Plusieurs types d’anomalies peuvent être observés (Figure 2).
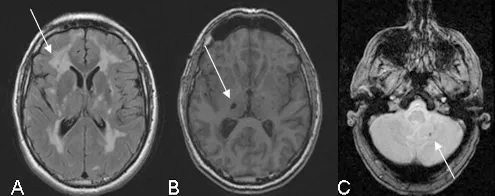
Figure 2 : Illustration des anomalies IRM rencontrées sur les séquences FLAIR (A), T1 (B) et écho de gradient (C)
Les Hypersignaux de la substance blanche (A) sont constants en présence de symptômes de la maladie. Ils sont observés sur les séquences pondérées en T2 qui montrent de vastes étendues hyperintenses au sein de la substance blanche associées à des anomalies plus focales au sein des noyaux gris, du thalamus et du tronc cérébral. L’étendue des hypersignaux de la substance blanche est variable et augmente avec l’âge. Chez les sujets de moins de 40 ans, les anomalies de signal sont habituellement punctiformes ou nodulaires et de répartition symétrique. Progressivement au cours de l’évolution de la maladie, les hypersignaux deviennent confluents et s’étendent à toute la substance blanche. La présence de ces anomalies de signal au niveau des pôles antérieurs des lobes temporaux (plus de 2 patients sur 3) a une valeur diagnostique très importante en particulier lorsqu’elles sont associées à la présence d’espaces périvascualaires dilatés à la jonction cortico-souscorticale (Figure 3). Cette atteinte du pôle tout antérieur des lobes temporaux n’est pas retrouvée dans les maladies artériolaires cérébrales dues à l’hypertension artérielle ou au diabète.
Les infarctus lacunaires (B) sont détectés sur les images pondérées en T1 sous la forme de zones limitées en hyposignal. Ils sont punctiformes ou plus larges en rapport avec la cavité se formant secondairement après la survenue d’un petit infarctus. Ces lésions sont observées chez environ deux patients sur trois ayant des anomalies de la substance blanche.
Ils sont présents au sein de la substance blanche, des noyaux gris et du tronc cérébral. Le volume total de ces lésions est fortement corrélé à la sévérité clinique de la maladie.
Des microsaignements (C) sont mis en évidence chez un patient sur trois en moyenne à l’aide de séquences pondérées en écho de gradient ou T2* très sensibles à l’accumulation des dérivés de l’hémoglobine dans le tissu cérébral. Ces saignements ne sont habituellement pas responsables de symptômes spécifiques mais leur présence semble le plus souvent associée à une atteinte plus sévère de la paroi vasculaire et de la maladie. Ils peuvent être localisés dans les régions profondes ou juxtacorticales des hémisphères cérébraux, au niveau du tronc cérébral ou du cervelet.
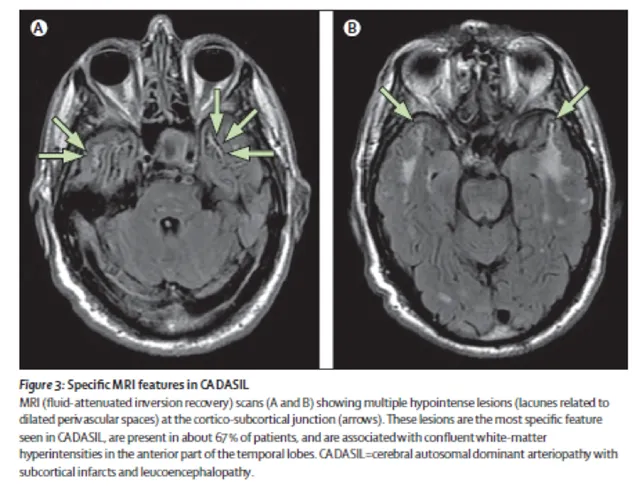
Figure 3: Anomalies IRM spécifiques de CADASIL
CADASIL est une maladie familiale héréditaire. Le mode de transmission est autosomique dominant (atteinte de même fréquence des sujets de sexe masculin et féminin, 50% des enfants issus d’un sujet atteint ayant l’anomalie génétique) (Figure 4).
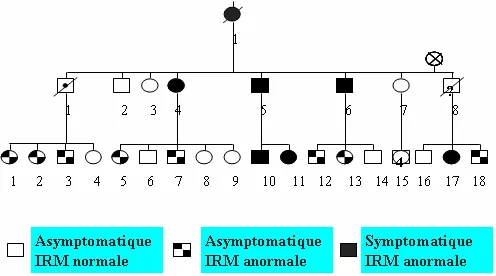
Figure 4 : Arbre généalogique au sein d’une famille montrant la transmission de type autosomique dominant et les résultats de l’examen IRM.
Le diagnostic doit être évoqué chez les patients ayant des lésions symétriques de la substance blanche et une histoire clinique de crises migraine avec aura, d’accidents ischémiques cérébraux transitoires ou constitués, de troubles de l’humeur ou de troubles cognitifs d’origine inexpliqués.
L’interrogatoire à la recherche d’antécédents évocateurs chez d’autres membres de la famille est indispensable. Une histoire de sclérose en plaques (le diagnostic erroné de sclérose en plaques est parfois évoqué chez les sujets jeunes après un premier évènement clinique), d’accidents vasculaires cérébraux ou de démence progressive avec des troubles moteurs chez des apparentés doivent faire évoquer une maladie familiale des petits vaisseaux. Il faut noter cependant que l’absence totale d’antécédent familial ne permet pas d’écarter le diagnostic en raison de la possibilité de mutation « de novo » du gène responsable à l’origine de cas sporadique.
La présence d’anomalies de signal, sur les séquences T2 ou FLAIR en IRM, à distribution symétrique, au niveau de la substance blanche, en particulier au niveau de la partie antérieure des lobes temporaux augmente la probabilité diagnostique de CADASIL en raison de leur spécificité.
Le bilan à la recherche d’une autre cause d’atteinte des artères cérébrales de petit calibre : bilan biologique simple, recherche d’un syndrome inflammatoire, de facteurs de risque vasculaire (bilan lipidique, homocystéinémie, glycémie à jeun, holter tensionnel), écho-doppler des vaisseaux du cou et transcrânien, est habituellement négatif.
Lorsque le diagnostic est suspecté, l’artériographie cérébrale (par voie intraveineuse) doit être évitée car elle peut être à l’origine de manifestations neurologiques sévères (céphalées importantes, crises de migraine avec aura sévère) parfois graves. Cet examen est le plus souvent normal, il peut montrer parfois un rétrécissement des petites artères. Une angiographie par résonance magnétique doit être préférée pour visualiser l’état des artères de moyen ou de gros calibre.

Pour confirmer le diagnostic de CADASIL, un test génétique sera réalisé dans tous les cas. Le gène impliqué est le gène Notch3, situé sur le bras court du chromosome 19. Il est constitué de 33 exons dont 23 exons (de 2 à 24) codent pour des motifs EFG-like qui comportent six résidus cystéine. A ce jour, toutes les mutations responsables de la maladie ont été localisées dans ces exons (exons 2 à 24). Ces mutations sont très stéréotypées et conduisent toutes au gain ou à la perte d’une cystéine dans un des motifs EGF-like. La présence d’une mutation de ce type permet d’affirmer le diagnostic de la maladie avec certitude. Dans la population française, dans 70% des cas la mutation siège dans les exons 3 ou 4 du gène Notch3 et dans 90 à 95% des cas la mutation siège dans l’un des 12 exons suivants 2, 3, 4, 5, 6, 7, 8, 11, 12, 18, 19 ou 20. En l’absence de mutation connue dans la famille du sujet atteint, les exons 3 et 4 (sensibilité 70%) sont d’abord testés, puis les exons 2, 5, 6, 7, 8, 11, 12, 18, 19 ou 20 (sensibilité 95%). Si les arguments en faveur du diagnostic sont très forts (importance de l’envoi des données cliniques et IRM) et si l’analyse précédente est négative, le criblage peut être étendu aux derniers exons du gène qui sont mutés chez un pourcentage très limité de patients CADASIL. La sensibilité estimée du criblage des 23 exons codant pour les domaines EGF de Notch 3 est proche de 100 %.
L’évolution des techniques de séquençage a maintenant supplanté l’étude de la biopsie de peau dans le diagnostic de la maladie. La biopsie cutanée n’est donc réalisée actuellement que lorsqu’il persiste un doute diagnostique à l’issue du séquençage des 23 exons du gène NOTCH3, ce qui est très rare ou en cas d’identification d’un variant de séquence n’impliquant pas un résidu cystéine et de signification inconnue. En cas de réalisation d’une biopsie de peau, un examen en microscopie électronique est réalisé à la recherche de matériel granulaire osmiophile (GOM) au niveau de la paroi vasculaire.
Le diagnostic génétique est possible avant l’apparition des symptômes de la maladie CADASIL pour les membres d’une famille atteinte. Cependant, la réalisation d’un test génétique chez un sujet sain n’ayant aucune manifestation clinique de la maladie et n’ayant eu aucun examen préalable n’est effectuée que dans le cadre d’une consultation spécialisée et multidisciplinaire. Après une évaluation neurologique (neurologue), psychologique (entretien avec un ou une psychologue) et une consultation de génétique (généticien), la demande du patient est évaluée de façon collégiale et un délai de réflexion de plusieurs semaines est proposé avant la réalisation d’un prélèvement sanguin. Le choix de ne pas être informé des résultats du test est préservé tout au long de la procédure, jusqu’à l’annonce des résultats. Un suivi clinique et psychologique est toujours proposé après l’annonce des résultats.
Aucun test génétique n’est actuellement réalisé chez les sujets mineurs asymptomatiques.
Les symptômes de la maladie sont principalement dus aux lésions survenant au niveau du cerveau au cours de la maladie. Les mécanismes à l’origine des hypersignaux de la substance blanche observées en IRM sur les séquences T2 et FLAIR et que l’on nomme leucoencéphalopathie sont imparfaitement connus. Une démyélinisation (perte des gaines de myéline fabriquées par les oligodendrocytes dans la substance blanche) et une perte des axones des neurones du cerveau en rapport avec une diminution de la perfusion cérébrale est le mécanismes habituellement évoqué. Mais d’autres mécanismes sont probablement impliqués. En effet, une étude récente a montré que l’étendue de ces hypersignaux apparaît liée à une augmentation du volume cérébral et non à l’atrophie cérébrale. Ces résultats suggèrent que la leucoencéphalopathie observée dans CADASIL pourrait être liée en partie à une augmentation du contenu en eau de certaines régions du cerveau. Cette leucoencéphalopathie est associée à de petits infarctus situés surtout en profondeur du cerveau et dus à l’interruption du flux sanguin dans une zone irriguée par une petite artère. Les infarctus peuvent laisser comme séquelle une petite cavité ou trou appelés « lacune ». Des traces de toutes petites hémorragies peuvent aussi être visibles chez un tiers des patients. Les études en imagerie cérébrale montrent que c’est principalement, l’accumulation des petits infarctus au niveau cérébral qui explique la gravité de la maladie au cours de CADASIL.
CADASIL est une maladie qui touche principalement la paroi des petites artères (artérioles) du cerveau (mais aussi des autres organes). La paroi des artères est souvent épaissie, parfois fibreuse. Les cellules musculaires lisses au niveau de la couche centrale de la paroi du vaisseau (média) sont anormales et ou en voie de disparition. A leur voisinage, on peut observer un matériel granuleux appelé GOM (granular osmiophilic material), tout à fait caractéristique de la maladie et visible en microscopie électronique. Des travaux chez l’homme mais aussi chez les souris ayant l’anomalie génétique ont montré que la paroi des petites artères ne se contractait pas ou ne se dilatait pas normalement. Il est possible que le rétrécissement de certains vaisseaux et cette réactivité anormale de la paroi expliquent le défaut d’irrigation observée au cours de cette affection.
Dans CADASIL, les mutations du gène NOTCH3 aboutissent à une accumulation dans la paroi du vaisseau d’une partie de la protéine mutée (domaine extracellulaire du récepteur NOTCH3) et à une agrégation à proximité de protéines de la matrice extracellulaire (qui constituent les GOM observés en microscopie électronique). La raison pour laquelle les cellules musculaires lisses fonctionnent anormalement et dégénèrent est encore inconnue. Le rôle important du gène Notch3 dans le développement des petites artères est par contre clairement démontré.
Aucun traitement préventif spécifique de la maladie n’est à ce jour connu dans CADASIL. En raison de la survenue d’infarctus cérébraux, l’aspirine est classiquement utilisée en prévention secondaire mais le bénéfice de ce traitement au cours de la maladie n’a pas été démontré. La survenue possible d’hémorragies intracrâniennes, même si elles sont rares suggère que l’utilisation d’anticoagulants serait par contre risquée.
Pour les crises de migraine avec aura, les vasoconstricteurs sont déconseillés en raison du risque théorique de réduction du débit sanguin cérébral chez des patients présentant un état hémodynamique précaire et une baisse du débit sanguin cérébral. Les anti-inflammatoires non stéroïdiens et les antalgiques sont donc recommandés en première ligne pour traiter les crises de migraine.
L’intérêt des inhibiteurs de l’acétylcholinestérase a été évalué récemment pour améliorer les patients ayant des troubles cognitifs. Cette étude s’est avérée négative pour le critère de jugement principal. Certaines analyses complémentaires suggèrent un effet favorable du donezepil sur les troubles des fonctions exécutives observés au cours de CADASIL mais devront être confirmées par de nouvelles études.
Tous les traitements hypotenseurs (neuroleptiques, anti-hypertenseurs) doivent être employés avec prudence en raison du risque éventuel de baisse du débit sanguin cérébral chez des patients ayant une perfusion du cerveau réduite.
Par contre, la kinésithérapie et la rééducation sont indispensables et doivent être prescrites largement lorsque des séquelles motrices, des troubles de la marche et de l’équilibre sont apparus, en particulier après la survenue d’un accident vasculaire cérébral. L’orthophonie est prescrite pour améliorer les capacités de communication et de langage lorsque cela est nécessaire.
Le soutien psychologique est crucial à toutes les étapes de la maladie, pour le patient mais aussi pour la famille et les accompagnants. Il comprend à la fois la prise en charge des conséquences psychologiques liées au déficit neurologique, l’évaluation des troubles psychologiques directement dus à la maladie, la prise en charge des conséquences du handicap au niveau familial, le soutien psychologique en raison du caractère familial et héréditaire de la maladie.

Les travaux de recherche actuels s’orientent actuellement dans deux directions :
1) sur le plan clinique, les études de suivi de patients ayant un CADASIL ont permis de préciser les paramètres cliniques et IRM qui expliquent la variabilité de la sévérité de la maladie. Ceci devrait permettre la mise en place d’un essai thérapeutique dans les années à venir. 2) l’étude des mécanismes moléculaires conduisant de l’anomalie génétique du gène NOTCH3 aux lésions observées au sein de la paroi du vaisseau qui se développe grâce à des modèles animaux de la maladie.
Ce document a été réalisé par ORPHANET en collaboration avec le CERVCO (D. Hervé, H. Chabriat) et l’association CADASIL France.
Source: CADASIL, Encyclopédie Orphanet Grand Public, avril 2008
http://www.orpha.net/data/patho/Pub/fr/CADASIL-FRfrPub1001v01.pdf
CADASIL est une maladie génétique touchant les petits vaisseaux sanguins au niveau du cerveau. Elle entraîne une mauvaise irrigation sanguine dans certaines zones du cerveau, qui provoque des symptômes très variables d’un malade à l’autre. Les manifestations les plus courantes de la maladie, qui apparaissent à l’âge adulte, sont des crises de migraine, des troubles psychiques et des accidents vasculaires cérébraux (AVC, voir plus loin), responsables de troubles du langage, de la mémoire, de la vision…
Le terme CADASIL a été proposé en 1993 par des chercheurs français pour désigner la maladie. C’est un acronyme signifiant en anglais « Cérébral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leukoencephalopathy », c’est-à-dire « artériopathie cérébrale autosomique dominante avec infarctus sous-corticaux et leucoencéphalopathie ».
Le terme « artériopathie cérébrale » signifie qu’il s’agit d’une atteinte des artères (vaisseaux amenant le sang depuis le cœur vers tous les organes) au niveau du cerveau.
« Autosomique dominante » désigne la façon dont la maladie se transmet d’une génération à l’autre, puisqu’il s’agit d’une maladie héréditaire.
Le terme « infarctus » correspond à l’arrêt brutal de la circulation sanguine dans une zone du corps, qui est, dans le cas de CADASIL, la zone « sous-corticale », une région particulière du cerveau.
Enfin, le mot « leucoencéphalopathie » fait référence aux lésions du cerveau dues à la maladie (voir plus loin).
La prévalence de CADASIL (nombre de personnes atteintes dans une population à un moment donné) n’est pas connue précisément, mais elle est estimée à 1 sur 24 000 personnes. Cette prévalence est probablement sous-estimée.
La maladie touche autant les hommes que les femmes. Les symptômes apparaissent à l’âge adulte, généralement entre 30 et 40 ans.
Initialement décrite en Europe, CADASIL a depuis été observée dans des populations d’origines très différentes partout dans le monde.
La maladie est due à l’anomalie (mutation) d’un gène, appelé NOTCH3.
Ce gène est important pendant le développement du fœtus puisqu’il contrôle, entre autres, la formation des vaisseaux sanguins, et plus précisément la formation de la couche musculaire qui est l’un des constituants des artères (figure 1).
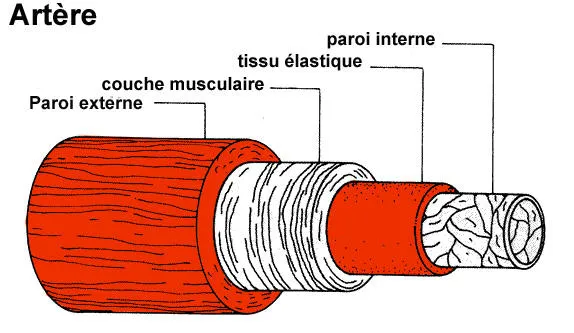
Figure 1
Une artère est une sorte de tube flexible constitué de différentes couches (ou tuniques) concentriques. L’une d’elles est une couche musculaire solide et élastique qui permet de maintenir le diamètre de l’artère et d’assurer la circulation du sang. Le gène NOTCH3 joue un rôle dans le développement de cette couche musculaire (http://www.ulb.ac.be/erasme/edu/fcc/hypertension/images/sch_artere_400.gif)
Du fait de l’anomalie du gène NOTCH3, la couche musculaire des artères est de mauvaise qualité et elle se dégrade progressivement. La paroi des artères devient moins élastique et la circulation du sang se fait moins facilement.
Malgré l’atteinte des petites artères de tous les organes, les conséquences de la maladie ne se manifestent qu’au niveau du cerveau, entraînant des problèmes neurologiques qui sont détaillés ci-dessous.
Certaines zones du cerveau, irriguées par de petites artères, sont privées de sang et donc d’oxygène (infarctus) par cette anomalie des petites artères. Or, l’oxygène est indispensable au bon fonctionnement et à la survie des cellules. C’est la répétition de ces petits infarctus dans une partie du cerveau qui provoque les symptômes et leur aggravation progressive.
Non, CADASIL n’est pas une maladie contagieuse, c’est une maladie génétique héréditaire.
La maladie est due à une anomalie des artères présente dès la naissance, mais les premiers symptômes n’apparaissent généralement qu’à l’âge adulte (vers 30-40 ans). Les symptômes sont très variables d’une personne à l’autre, y compris au sein d’une même famille (bien qu’elles aient la même anomalie génétique). Ainsi, tous les malades ne présentent pas l’ensemble des manifestations décrites ci-dessous. De même, l’intensité des symptômes et donc le handicap lié à la maladie sont imprévisibles et très variables.
Les crises de migraine sont fréquentes au cours de la maladie et constituent souvent le premier symptôme. Il s’agit de maux de tête très intenses (d’un seul côté de la tête le plus souvent), parfois accompagnés de nausées, de vomissements et d’une intolérance au bruit et à la lumière (besoin de silence et d’obscurité). Ces maux de tête peuvent survenir seuls, mais ils sont souvent précédés de sensations anormales appelées « aura ». Les crises de migraine avec aura concernent un malade sur quatre environ. La fréquence des crises est extrêmement variable, allant de deux épisodes par semaine à un tous les 3 ou 4 ans.
Les signes précurseurs, ou auras, diffèrent selon les malades. Ils durent en moyenne de 20 à 30 minutes, puis le mal de tête apparaît. Il s’agit souvent de troubles de la vision : passage de formes brillantes devant les yeux, de taches colorées, apparition brutale d’un point lumineux scintillant dans la zone centrale du champ de vision (scotome scintillant), et, plus rarement, d’une vision brouillée ou de la perte de la vue dans une moitié du champ visuel (hémianopsie).
D’autres signes peuvent survenir et notamment des troubles de la sensibilité : engourdissement, picotements, fourmillements, faiblesse musculaire, voire paralysie, d’un seul côté du corps. Ces sensations peuvent parfois se propager à tout le corps.
Des troubles de la parole peuvent également apparaître, se traduisant souvent par des difficultés à trouver ses mots (aphasie) ou à articuler. L’aura peut également se manifester par un sentiment de dépression, d’anxiété ou d’agitation.
Les malades peuvent également souffrir d’une migraine « simple », sans aura. Cependant, les crises de migraine sans aura ne sont pas plus fréquentes dans CADASIL que dans la population générale.
Les crises de migraine peuvent être très douloureuses, voire insupportables, et durer plusieurs heures, parfois plusieurs jours. Parfois, les crises sont tellement sévères qu’elles nécessitent une hospitalisation.
Les accidents vasculaires cérébraux, souvent appelés « attaques » en langage courant, surviennent au cours de la maladie lorsqu’une zone du cerveau est soudainement privée d’irrigation sanguine (infarctus ou ischémie). Les AVC à répétition sont le signe le plus fréquent de la maladie, touchant plus de trois malades sur quatre. Ils surviennent le plus souvent entre 40 et 50 ans.
Ils peuvent entraîner différents symptômes apparaissant brutalement : paralysie d’un côté du corps (hémiplégie) ou perte de la sensibilité d’une partie du corps, troubles de la parole, de l’équilibre ou de la coordination des mouvements.
Ces troubles peuvent régresser en moins de 24 h, mais ils peuvent devenir définitifs au fur et à mesure que la maladie évolue. Lorsqu’ils sont « passagers », on parle d’AVC transitoires, et d’AVC « constitués » si les troubles sont irréversibles.
Des troubles de l’humeur surviennent dans 20 % des cas environ, soit après un AVC, soit à n’importe quel moment au cours de l’évolution de la maladie. Certains malades présentent ainsi des signes dépressifs importants et une perte de motivation et d’intérêt pour le travail, les activités, les projets (apathie)… Dans de rares cas, les phases de dépression alternent avec des phases d’hyperactivité (dépenses inconsidérées, propos ou comportements inhabituels, excès divers…). On parle alors de troubles maniaco-dépressifs. L’existence de ces troubles psychiatriques peut être à l’origine d’erreurs de diagnostic, surtout lorsqu’ils sont les premiers signes de la maladie.
Des troubles dits « cognitifs » peuvent également survenir, et ce dès le début de la maladie. Cependant, ils ne deviennent importants qu’entre 50 et 60 ans. Ils se traduisent par des troubles de la concentration, de l’attention, ou des troubles de la mémoire d’importance variable. Les personnes atteintes ont souvent du mal à organiser une activité, à planifier les choses, à prendre des initiatives… Il est également difficile pour elles de s’adapter à de nouvelles situations et à gérer les changements qui surviennent dans leur quotidien. Il s’agit alors d’une atteinte des fonctions exécutives (organisation, planification) et de perte de la flexibilité ou de la souplesse mentale.
Progressivement, avec l’âge, le déclin intellectuel peut s’accentuer, soit progressivement, soit par paliers (aggravations soudaines et importantes). Les troubles de l’attention et de la mémoire deviennent de plus en plus importants, tout comme la perte de l’initiative. L’aggravation de ces troubles peut conduire à une perte de l’autonomie : on parle alors de démence ou de syndrome démentiel.
La démence est observée chez un tiers des malades, mais sa fréquence augmente avec l’âge. Après l’âge de 60 ans, environ 60 % des malades ont une démence.
Celle-ci peut être associée à d’autres signes comme des troubles de la marche, une impossibilité de se retenir d’uriner (incontinence urinaire) et dans certains cas à des difficultés pour avaler (troubles de la déglutition).
Dans moins de 10 % des cas, les malades présentent également des crises d’épilepsie. Les manifestations des crises sont variables : mouvements ou convulsions (secousses musculaires, tremblements, raideurs), troubles de la sensibilité et des sens (fourmillements, engourdissements, hallucinations auditives ou visuelles se traduisant par le fait d’entendre des sons ou de voir des images qui n’existent pas…), troubles psychiques (peur panique ou crise de panique, troubles de la mémoire, confusion, perte de connaissance, absences (c’est-à-dire pertes soudaines du contact avec l’environnement), dont la personne ne se souvient pas ensuite) ou encore salivation excessive, fuites urinaires… Les crises peuvent toucher tout le corps (crises généralisées), ou plus souvent une partie limitée ou une moitié du corps (crises partielles).
Les épisodes de privation d’oxygène du fait de la mauvaise irrigation sanguine endommagent certaines zones du cerveau, créant des lésions. En effet, après quelques minutes sans apport sanguin, certaines cellules sont définitivement détruites. Plus précisément,
c’est la substance « blanche » du cerveau qui souffre le plus souvent au cours de cette maladie : c’est pourquoi on parle de « leucoencéphalopathie » (leuko signifiant « blanc » en grec). La substance blanche est composée de faisceaux de « câbles », appelés axones, qui sont les prolongements des cellules nerveuses ou neurones (figure 2). Ces câbles sont recouverts d’une gaine isolante, appelée myéline, comparable à l’isolant recouvrant les fils électriques.
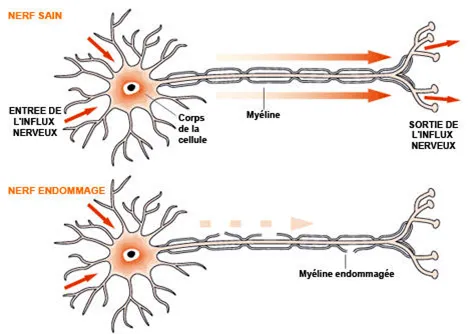
Figure 2
Les cellules nerveuses se prolongent par des « axones », recouverts d’une gaine blanche de myéline. Ce sont ces axones, constituant un véritable câblage dans le cerveau, qui composent la substance blanche dans laquelle se forment les lésions au cours de CADASIL (gentillesse http://www.handicapinfos.com)
La myéline favorise la transmission du message nerveux qui assure le fonctionnement du cerveau. Chez les personnes atteintes de CADASIL, en raison des petits infarctus et microhémorragies à répétition, la myéline est altérée, voire détruite (on parle de démyélinisation) dans certaines zones du cerveau. Cette altération gêne ou empêche la transmission des messages nerveux dans le cerveau. Elle est responsable de la perte progressive d’autonomie.
Les épisodes d’interruption de la circulation sanguine semblent être de plus en plus fréquents et sévères au cours de l’évolution de la maladie, ce qui explique l’accumulation progressive des lésions cérébrales et l’aggravation des symptômes. Lorsqu’il y a une lésion dans le cerveau, celle-ci est définitive mais il existe une capacité de récupération par d’autres circuits qui se mettent en place pour compenser ce déficit. Cependant, cette capacité diminue progressivement, les troubles devenant alors de plus en plus évidents.
La raison pour laquelle certaines personnes développent une forme plus sévère de la maladie est inconnue.
Le plus souvent, la maladie se caractérise par l’apparition des crises de migraine avec ou sans aura après l’âge de 30 ans, puis par la survenue d’accidents vasculaires cérébraux, une dizaine d’années plus tard, et par l’apparition progressive de troubles cognitifs (problèmes de concentration, de mémoire…), de troubles de l’équilibre et de la marche vers l’âge de 60 ans. Après 60 ans, la perte d’autonomie et le déclin intellectuel peuvent être prononcés.
Cependant, la sévérité de la maladie est très variable d’une personne à l’autre, y compris au sein d’une même famille. L’évolution est donc plus ou moins rapide, certains malades présentant un handicap important très tôt, vers l’âge de 40 ans, et d’autres n’ayant les premiers symptômes qu’après l’âge de 60 ans par exemple.
Le diagnostic de la maladie s’appuie initialement sur l’imagerie par résonance magnétique (IRM). Cet examen indolore consiste à obtenir des images précises du cerveau en plaçant le malade dans un appareil produisant un champ magnétique. Le diagnostic par IRM est complété par le test génétique.
Dans le cas de CADASIL, l’IRM détecte des lésions caractéristiques de la maladie dans la substance blanche du cerveau (figure 3). Les lésions apparaissent généralement entre 20 et 35 ans, mais elles peuvent être présentes de nombreuses années sans provoquer de symptômes. Après l’âge de 35 ans, toutes les personnes porteuses du gène anormal NOTCH3, présentant ou non des symptômes, ont des anomalies visibles à l’IRM évocatrices de CADASIL. Le nombre et l’importance des anomalies observées en IRM augmentent avec l’âge.
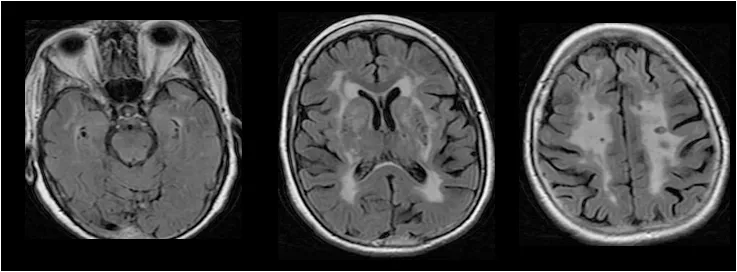
Figure 3
Illustration des anomalies observées en IRM dans la substance blanche d’une personne atteinte de CADASIL. Certaines zones, plus claires, renvoient un signal anormal. (http://cervco.aphp.fr/pathologies/pathologies.xml)
Le diagnostic de CADASIL est confirmé en recherchant les anomalies du gène NOTCH3, par prise de sang. Cette recherche requiert un encadrement et un suivi particuliers.
Les AVC sont relativement fréquents dans la population générale, surtout chez les personnes âgées, diabétiques, hypertendues, chez les fumeurs ou en cas de taux de cholestérol élevé. La maladie CADASIL n’est donc pas forcément évoquée lors des premiers symptômes d’AVC. Cependant, la visualisation des lésions typiques du cerveau par IRM permet d’alerter le médecin sur l’existence d’une maladie spécifique. Lorsqu’il existe des cas déjà diagnostiqués dans la famille, le diagnostic de CADASIL est plus facile à faire. Cependant, l’IRM et le test génétique restent nécessaires pour confirmer le diagnostic car les symptômes neurologiques peuvent être dus à d’autres affections. Parmi les maladies « ressemblantes », on trouve notamment la leucoencéphalopathie multifocale progressive, la sclérose en plaques, l’angiopathie amyloïde cérébrale, ou encore la maladie d’Alzheimer.
CADASIL est une maladie génétique héréditaire. Son mode de transmission est autosomique dominant, c’est-à-dire qu’une personne atteinte a une probabilité de 1 sur 2 de transmettre le gène anormal à ses enfants (Figure 4). Toutes les personnes ayant hérité du gène anormal développeront à un moment ou un autre des symptômes de la maladie. Cependant, leur sévérité peut varier considérablement d’une personne atteinte à l’autre, y compris au sein de la même famille.
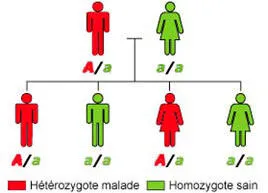
Figure 4
Sur ce schéma, le père possède le gène NOTCH3 muté (A) responsable de CADASIL. Il a un risque sur deux de transmettre ce gène à ses enfants, qui développeront à leur tour la maladie. La transmission se fait de la même manière si c’est la mère qui est atteinte.
Dans quelques cas exceptionnels identifiés, la mutation du gène NOTCH3 est survenue « par hasard » (mutation de novo), sans avoir été transmise par l’un des parents.
Le test de dépistage est possible avant l’apparition des symptômes de la maladie pour les membres de la famille d’une personne atteinte (test pré-symptomatique). Il consiste à déterminer si la personne possède l’anomalie génétique et donc si elle développera un jour la maladie.
Cependant, un test génétique chez une personne n’ayant aucune manifestation de la maladie n’est effectué que dans le cadre d’une consultation spécialisée et d’un encadrement médical et psychologique précis. Aucun test ne peut être réalisé chez les personnes de moins de 18 ans qui ne présentent pas de symptômes.
Après un examen par un neurologue permettant à la personne concernée d’obtenir des informations sur CADASIL, un entretien avec un psychologue et un généticien est effectué. La décision d’avoir recours ou non à ce test pré-symptomatique étant complexe et difficile à prendre, la personne concernée doit en effet être informée et encadrée du mieux possible. Le psychologue peut ainsi évaluer l’état psychologique du sujet, l’état de ses réflexions et interrogations sur la maladie, ainsi que sa capacité à appréhender un diagnostic difficile. Le généticien explique le test et la signification des résultats.
Lorsque la personne choisit de faire le test, un délai de réflexion de un ou deux mois est requis avant d’effectuer le prélèvement sanguin. A tout moment, il lui est possible de se rétracter et de choisir de ne pas connaître le résultat. Un accompagnement médical et psychologique est toujours proposé après l’annonce du résultat (obtenu environ 3 mois après le prélèvement de sang), qu’il soit positif ou négatif.
Dans les familles au sein desquelles la maladie est particulièrement sévère, une demande de diagnostic prénatal est parfois exprimée.
Le but du diagnostic prénatal est de déterminer au cours de la grossesse si l’enfant à naître est porteur de la mutation et développera donc la maladie à l’âge adulte (les parents pouvant dans ce cas demander une interruption médicale de grossesse). Le diagnostic prénatal se fait par prélèvement du liquide dans lequel baigne le fœtus (amniocentèse) ou d’un fragment de placenta (prélèvement des villosités choriales).
Il est également possible d’effectuer un diagnostic préimplantatoire (DPI). Le DPI consiste à rechercher l’anomalie génétique responsable de la maladie sur des embryons obtenus par fécondation in vitro. Cette technique permet de sélectionner les embryons qui n’ont pas l’anomalie génétique pour les implanter dans l’utérus et éviter ainsi aux parents l’épreuve de l’interruption médicale de grossesse tardive.
Or, si le diagnostic prénatal et le DPI sont techniquement réalisables, le recours à ces techniques est néanmoins exceptionnel. En effet, CADASIL est une maladie qui ne se déclenche qu’à l’âge adulte et dont la sévérité est variable d’un malade à l’autre, même au sein de la même famille. Ainsi, même si certains membres de la famille sont ou ont été sévèrement atteints lorsqu’ils étaient relativement jeunes, rien n’indique que les enfants à venir, s’ils sont porteurs du gène malade, présenteront eux aussi précocement des symptômes sévères.
Ces démarches représentent un parcours long, nécessitant un accompagnement de la part de l’équipe soignante.
Actuellement, il n’existe pas de traitement permettant de guérir la maladie ni d’éviter son apparition. Il est toutefois possible de traiter les symptômes au fur et à mesure qu’ils apparaissent afin d’améliorer la qualité de vie des malades. Des recherches sont en cours afin d’identifier des pistes de traitements permettant de retarder leur apparition.
Les antalgiques (antidouleurs) classiques comme le paracétamol, l’ibuprofène et l’aspirine (anti-inflammatoires non stéroïdiens) sont utilisés contre les crises de migraine. Ils sont cependant souvent insuffisants.
Les médicaments habituellement utilisés pour traiter les migraines, dits « vasoconstricteurs », sont déconseillés chez les personnes atteintes de CADASIL car ils entraînent une contraction des vaisseaux risquant de réduire la circulation sanguine au niveau du cerveau.
L’aspirine est classiquement utilisée après un premier AVC, à titre préventif. Elle permet de fluidifier le sang et de limiter la formation de bouchons (caillots) en cause dans la plupart des AVC survenant dans la population générale. En revanche, chez les personnes atteintes de CADASIL, l’effet bénéfique de l’aspirine n’a pas été clairement démontré. Dans le doute, la plupart des médecins prescrivent tout de même ce traitement, à doses variables en fonction des malades, sauf en cas de contre-indication (ulcère à l’estomac, allergie…).
Les troubles psychiatriques, qui peuvent se traduire par des signes dépressifs ou maniacodépressifs, peuvent être traités par des médicaments antidépresseurs, mais ceux-ci se révèlent parfois insuffisamment efficaces voire inefficaces.
Après un accident vasculaire cérébral, la kinésithérapie est indispensable pour prendre en charge les éventuels troubles moteurs (marche, équilibre…). En cas de troubles de la parole, une rééducation orthophonique est conseillée. En cas de séquelles importantes (par exemple, des paralysies), la psychomotricité et l’ergothérapie permettent d’accompagner le malade en l’aidant à gérer son handicap et à accepter l’image de son corps, afin qu’il puisse évoluer au mieux dans son environnement.
Quant à la prise en charge des troubles cognitifs, elle peut passer par la participation à des groupes adaptés (avec d’autres malades par exemple), permettant de stimuler le malade, d’éviter son isolement et de limiter le sentiment d’être une charge pour l’entourage.
En cas de perte d’autonomie (ralentissement intellectuel, troubles du comportement, importantes difficultés motrices), le malade peut avoir besoin d’une aide spécialisée à domicile, voire d’être hospitalisé en maison médicale spécialisée où il sera assisté dans la vie quotidienne (hygiène, alimentation).
Un soutien psychologique est souvent indispensable, à toutes les étapes de la maladie, tant pour le malade que pour sa famille.
L’annonce du diagnostic est un moment difficile, où se mêlent sentiments d’injustice, d’impuissance et de désespoir, dans la mesure où il s’agit d’une maladie qui ne se traite pas, dont on ne peut pas prévoir l’évolution, et qui est responsable à terme d’un déclin physique et intellectuel.
De plus, s’agissant d’une maladie familiale, la peur de transmettre (ou d’avoir transmis) la maladie à ses enfants est souvent intense et associée à un sentiment de culpabilité. Le soutien psychologique peut aider à mieux accepter cette situation et à mieux gérer l’anxiété liée à la maladie.
Pour la famille (frères et sœurs, enfants), le soutien psychologique est important pour aider à prendre une décision concernant le test de dépistage, ou à accepter de vivre dans l’incertitude sans renoncer pour autant à ses projets. Pour les personnes qui se savent atteintes mais qui n’ont pas encore développé de symptômes, ou pour les membres de la famille qui ne savent pas s’ils sont porteurs du gène anormal, il est « naturel » de s’inquiéter au moindre signe neurologique (maux de tête, picotements dans un membre…). Cependant, CADASIL n’est pas forcément en cause et deux personnes ayant la même anomalie génétique n’auront pas obligatoirement les mêmes symptômes, ni la même évolution. L’aide d’un psychologue, en complément de diverses méthodes de relaxation, peut être utile pour calmer ces angoisses.
Il n’y a pas de recommandation particulière, mais il est toutefois préférable d’avoir une bonne hygiène de vie et de ne pas fumer (car cela augmente le risque d’AVC). Il est également recommandé de faire contrôler régulièrement sa tension artérielle.
Généralement, pour éviter toute prise de risque inutile, le traitement hormonal de la ménopause n’est maintenu que s’il apporte un réel bénéfice (traitement des bouffées de chaleur…), et ce sur une durée limitée. En ce qui concerne la contraception, une pilule ne comprenant que des progestatifs (sans œstrogènes) peut-être préférée à la pilule classique.
Le suivi des personnes atteintes de CADASIL est assuré dans des consultations de neurologie hospitalière spécialisées. Il existe en France un centre de référence pour les maladies vasculaires du système nerveux central (dont les coordonnées se trouvent sur le site www.orphanet.fr). La fréquence des visites et des examens sera déterminée par l’équipe médicale.
Certains symptômes doivent néanmoins alerter le malade et son entourage et l’inciter à consulter en urgence. Ainsi, un AVC peut se traduire par des troubles de la vision ou du langage, des difficultés soudaines à bouger un membre (il devient par exemple difficile d’écrire), des troubles de la coordination des mouvements… De même, en cas de violents maux de tête avec ou sans aura, ou de crises d’épilepsie, il est conseillé de consulter rapidement son médecin.
En cas d’urgence, il est important de communiquer le diagnostic de CADASIL aux médecins pour éviter certains traitements ou examens. En effet, les médicaments anticoagulants, parfois donnés après un AVC, sont fortement déconseillés en cas de CADASIL car il existe un risque de saignement dans le cerveau. De même, les artériographies cérébrales (examens permettant de visualiser la circulation du sang dans les artères du cerveau) doivent être évitées car elles peuvent être à l’origine de crises de migraine parfois graves. Enfin, il est impératif de signaler au personnel soignant quels sont les traitements en cours et leur dose. Cette précaution permet d’éviter les associations de médicaments incompatibles et les éventuels surdosages.
A ce jour, il n’existe aucun moyen, avec une efficacité démontrée, de prévenir la survenue ou les manifestations de CADASIL.
Être atteint d’une maladie évolutive qui entraîne tôt ou tard un déclin physique et intellectuel est extrêmement difficile, bien qu’on ne puisse pas prévoir la sévérité du handicap ni la rapidité d’évolution, qui sont très variables d’une personne à l’autre. Les troubles neurologiques finissent par perturber des fonctions essentielles, comme la marche ou la parole, et sont donc très handicapants. L’état du malade peut rester stable pendant un certain temps, mais les aggravations survenant pendant la vie active peuvent nécessiter un arrêt de l’activité professionnelle, ou du moins une réorientation ou une réorganisation du temps de travail. De plus, en cas d’AVC, une hospitalisation suivie d’une rééducation souvent longue sont indispensables pour permettre aux malades de se rétablir et de récupérer le plus de facultés possible.
Pour les personnes ayant déjà des symptômes comme pour celles se sachant (ou se croyant) atteintes par la maladie, le sentiment de vivre avec une menace permanente peut-être difficile à gérer et source d’une grande anxiété. Le caractère imprévisible de la maladie est particulièrement difficile à accepter.
Lorsque la maladie est très avancée, le malade perd peu à peu son autonomie et devient incapable d’effectuer seul les gestes quotidiens (toilette, repas…). Pour l’entourage du malade, les troubles de l’humeur, les troubles psychologiques, accompagnés de difficultés motrices ou d’incontinence éventuelles sont très difficiles à supporter. Ils sont souvent responsables d’un isolement social, les amis et parfois la famille ne comprenant pas toujours les changements de comportement de la personne atteinte. Le malade, lorsqu’il devient incapable de prendre des décisions, doit parfois être placé sous tutelle judiciaire. Le tuteur, souvent un membre de la famille, doit assurer à la place du malade la gestion financière.
A un stade avancé de la maladie, afin d’alléger la charge que représente le maintien du malade à domicile, des interventions extérieures (services de soins infirmiers, garde-malade, auxiliaire de vie, aide-ménagère ou placement en institut spécialisé) peuvent être mises en place. Ces périodes de « répit » pour la famille sont primordiales.
Il est possible d’avoir des enfants lorsque l’on est atteinte de CADASIL ou lorsque l’on est porteuse de l’anomalie génétique responsable de la maladie. La grossesse ne semble pas augmenter le risque d’AVC et elle ne déclenche pas non plus de symptômes chez une femme n’ayant jamais eu de manifestations de la maladie.
Cependant, au cours du mois suivant l’accouchement, le risque de crises de migraine avec aura sévère serait augmenté. Il est donc important de discuter avec son médecin de tout désir de grossesse et de l’informer si l’on est enceinte, car il pourra évaluer les risques pour la femme et le futur bébé, et assurer un suivi adapté.
La recherche a pour objectif de préciser les mécanismes par lesquels l’anomalie du gène N0TCH3 conduit aux lésions des artères cérébrales. Pour ce faire, des souris présentant une anomalie du gène N0TCH3 ont été obtenues. Les facteurs déterminant la sévérité des symptômes et de l’évolution, variables d’un malade à l’autre, sont également à l’étude.
Sur le plan clinique, des essais thérapeutiques sont envisagés, notamment pour évaluer l’efficacité des médicaments « vasodilatateurs » ou « neuroprotecteurs ».
Ces travaux sont conduits par différentes équipes dans le monde.
En contactant les associations de malades consacrées à cette maladie. Vous trouverez leurs coordonnées en appelant Maladies Rares Info Services au 08 10 63 19 20 (Numéro azur, prix d’un appel local) ou en consultant Orphanet (www.orphanet.fr)
Il est important de trouver les bons interlocuteurs pour se faire aider dans les démarches administratives. Des conseils précieux peuvent être fournis d’une part par les assistantes sociales à l’hôpital et par les associations de malades qui sont au courant de la législation et des droits. D’autre part, les Services Régionaux d’Aides et d’Informations (SRAI) aident et accompagnent les familles dans les démarches quotidiennes en les mettant en contact avec des techniciens d’insertion (kinésithérapeutes, ergothérapeutes, travailleurs sociaux …).
En France, certains malades atteints de CADASIL peuvent être pris en charge à 100 % par la Sécurité Sociale en ce qui concerne le remboursement des frais médicaux (exonération du ticket modérateur). Les séances de kinésithérapie et d’orthophonie sont prises en charge par la Sécurité Sociale. Les malades ont la possibilité d’obtenir une allocation d’adulte handicapé en présentant un dossier auprès de la Maison Départementale des Personnes Handicapées (MDPH). Suivant leur état, une prestation de compensation du handicap peut aussi être allouée aux malades. Enfin, une carte d’invalidité permet aux personnes handicapées majeures ou mineures, dont le taux d’incapacité dépasse 80 %, de bénéficier de certains avantages fiscaux ou de transports. La carte « station debout pénible » et le macaron permettant de se garer sur les places réservées aux personnes handicapées peuvent être obtenus en fonction de l’état de la personne atteinte. L’orientation vers les établissements spécialisés est sous le contrôle de la Commission des Droits et de l’Autonomie des Personnes Handicapées (CDAPH), organisée au sein de la MDPH.
Pour plus de précisions, vous pouvez consulter le cahier Orphanet « Vivre avec une maladie rare en France : aides et prestations », qui compilent toutes les informations sur la législation en cours, les aides, les modalités de scolarisation et d’insertion professionnelle disponibles pour les personnes atteintes de maladies rares.

Madame Catherine SURJOUS
Présidente de CADASIL France
E-mail : president.cadasil@yahoo.fr
Tél. : 06 41 37 47 77 (laisser un message avec les coordonnées pour que les patients puissent être rappelés)
Un guide des aidants ou des accompagnants de malades de CADASIL a été réalisé par un groupe de travail mandaté par le Conseil d’administration de l’association CADASIL France et en collaboration avec l’équipe médicale du CERVCO. Vous pouvez le télécharger en cliquant ici.
Pharmacien de formation et diplômée de l’ESSEC, Marion Pineau possède plus de 20 ans d’expérience en gestion de projet marketing et communication dans les domaines de la santé, prévention et bien-être. Son expertise couvre aussi bien la communication scientifique et institutionnelle que la coordination de projets impliquant médecins, patients et associations.
Au sein du CERVCO, elle pilote le développement des actions du centre, notamment l’organisation des Réunions de Concertation Pluridisciplinaires, les projets PNDS et le suivi des parcours de soins pour les maladies rares vasculaires du cerveau et de l’œil. Elle assure également le lien avec la plateforme d’expertise Paris Nord, la filière BRAIN-TEAM et le réseau européen VASCERN pour renforcer les synergies et favoriser l’innovation au bénéfice des patients.
Passionnée par la transmission et l’accessibilité de l’information en santé, elle contribue activement à la visibilité du CERVCO, notamment via son site internet, en veillant à rendre les contenus clairs et accessibles à tous les publics concernés (patients, professionnels de santé, associations).
D’abord secrétaire dans le secteur privé dés 1986, Solange Hello a intégré l’équipe du Service de Neurologie de l’hôpital Lariboisière en 2001. Elle a initialement exercé les fonctions de secrétaire de recherche et s’est investie dans le suivi de Projets Hospitaliers de Recherche Clinique concernant les maladies vasculaires cérébrales rares. Elle assure la fonction de secrétaire pour le CERVCO depuis le 1er janvier 2007.
Après l’obtention d’un doctorat en chimie de l’Université Claude Bernard Lyon I en 2005 et quelques années de recherche fondamentale Abbas Taleb a suivi une formation d’Attaché de Recherche Clinique (ARC) à l’institut Leonard De Vinci à Paris en 2010. Au décours de cette formation, il a intégré l’équipe du CERVCO et exerce actuellement la fonction de coordinateur d’essais cliniques. Il est responsable du recueil de données concernant les cohortes maladies rares.
Fanny Fernandes est docteur en Neurosciences. Après 15 ans de recherche préclinique en neurobiologie, sur les processus de myélinisation et de développement des glioblastomes, elle s’est tournée vers la recherche clinique en suivant les enseignements du DIU FIEC. Elle a ensuite animé le réseau national de recherche clinique FCRIN CRI-IMIDIATE sur les maladies auto-inflammatoires et auto-immunes puis le FHU ADAPT autour du développement de la médecine personnalisée en psychiatrie. Au sein du CERVCO elle anime le programme de recherche RHU Trt_cSVD qui a pour objectif de lutter contre les maladies des petits vaisseaux cérébraux en utilisant des approches pluridisciplinaires pour aboutir à des propositions innovantes pour la prise en charge des patients.
Diplômée d’un doctorat en pharmaco-oncologie, Estelle Dubus s’est d’abord intéressée à l’inhibition de l’angiogenèse dans les tumeurs pédiatriques comme cible thérapeutique et à la caractérisation des mécanismes de résistance associés. Au travers du programme de médecine personnalisée MAPPYACTS (#NCT02613962 ), elle a mis en place et coordonné un réseau national et européen de développement de modèles précliniques de tumeur pédiatrique en rechute. Après 15 ans en oncologie, elle a repris l’animation du DHU NeuroVasc et a structuré la recherche clinique au sein du département de neurologie. Aujourd’hui, chef de projet de la FHU NeuroVasc2030, elle anime le réseau neurovasculaire francilien dans le but de faire émerger de nouveaux projets : de la conception à la publication, coordination des équipes, animation des réseaux professionnels et veille au bon déroulement scientifique, réglementaire et budgétaire de chaque étape. Au sein du CERVCO, elle coordonne les essais cliniques et la remontée des données de file active, aide à la structuration des cohortes et bases de données, accompagne les collaborations et la réponse aux appels à projet.
Marie-Hélène De Sanctis est psychologue spécialisée en neuropsychologie au sein du service de Neurologie de l’Hôpital Lariboisière depuis 2017. Elle réalise des évaluations neuropsychologiques, anime des ateliers d’Éducation Thérapeutique du Patient et assure le suivi et le soutien psychologique des patients et de leurs proches. Elle intervient également au CERVCO pour l’évaluation neuropsychologique des patients atteints de maladies vasculaires rares du cerveau et de l’œil. Chargée de cours invitée à l’Université Paris 8, elle est également co-autrice d’une publication sur les manifestations insulaires en neuro-oncologie.
Sonia Reyes est psychologue à l’Assistance Publique. Elle a débuté son activité dans le Service de Neurologie du Pr. Bousser à l’hôpital Lariboisière et parallèlement au Centre de Neuropsychologie et du Langage dirigé par le Pr. Bruno Dubois à la Salpêtrière. Elle y a acquis une compétence particulière dans le dépistage de troubles cognitifs associés aux pathologies neurodégénératives et vasculaires du cerveau. Elle est actuellement psychologue au sein du département de neurologie de l’hôpital Lariboisière où elle prend en charge l’évaluation neuropsychologique des patients. Elle assure également la prise en charge psychologique de ces patients et de leur famille.
Au sein du CERVCO, elle assure l’évaluation neuropsychologique des patients, leur suivi, le soutien psychologique des patients et des familles. Enfin, elle participe des travaux de recherche clinique sur les troubles cognitifs au cours des pathologies neuro-vasculaires rares.
Aude Jabouley est psychologue à l’Assistance Publique depuis 9 ans. Elle a commencé à travailler en consultation mémoire dans les Hôpitaux Vaugirard-Gabriel Pallez et Paul Brousse. Elle y a acquis une compétence particulière dans le dépistage de troubles cognitifs associés aux pathologies neurodégénératives et vasculaires du cerveau. Depuis 7 ans et demi, elle est psychologue au sein du pôle « neuro sensoriel tête et cou » du Groupe Hospitalier Lariboisière-Fernand Widal où elle prend en charge l’évaluation neuropsychologique des patients. Elle assure également la prise en charge psychologique de ces patients et de leur famille.
Au sein du CERVCO, elle assure l’évaluation neuropsychologique des patients et leur suivi ainsi que le soutien psychologique des patients et des familles. Enfin, elle effectue actuellement des travaux de recherche clinique sur les troubles cognitifs au cours des pathologies neuro-vasculaires rares, en particulier la maladie de CADASIL.
Carla Machado est psychologue à l’Assistance Publique depuis 2012. Elle a commencé son activité clinique dans le service de Consultation Mémoire à l’hôpital Albert Chenevier où elle a développé une compétence dans l’évaluation des troubles cognitifs associés aux maladies neurodégénératives. Depuis, elle a rejoint l’équipe de psychologue dans le service de Neurologie du groupe hospitalier Lariboisière-Fernand Widal où elle prend en charge l’évaluation neuropsychologique des patients. Elle assure également la prise en charge psychologique de ces patients et de leur famille.
Au sein du CERVCO, elle assure les entretiens cliniques au sein des consultations multidisciplinaires pré symptomatique dans la maladie de CADASIL et participe aux consultations neurologiques dans le cadre de la remise des résultats génétiques. Elle participe également à des protocoles de recherche clinique sur les maladies neuro-vasculaires rares et est responsable du programme d’éducation thérapeutique du patient (ETP) pour l’angiopathie de moyamoya.
Le Professeur Homa Adle-Biassette est Chef du Service d’Anatomie et de Cytologie pathologique. Elle est Professeur d’Anatomie Pathologique. Elle est également membre de l’équipe INSERM 1141. Son intérêt principal est la neuropathologie et plus particulièrement le développement du système nerveux central. Elle a publié plus de 100 articles scientifiques dans le domaine de la neuropathologie.
Le Docteur Valérie Krivosic est ophtalmologiste, spécialisée dans les pathologies médicales et chirurgicales de la rétine. Après avoir réalisé un DEA dans l’unité INSERM dirigée par le professeur Tournier-Lasserve à l’université Paris VII, elle a été chef de clinique dans le service d’ophtalmologie dirigé par le professeur Gaudric à l’hôpital Lariboisière à Paris pendant 3 ans. Elle a ainsi acquis une compétence dans les pathologies de la vascularisation rétinienne tant sur le plan chirurgical (pour la rétinopathie diabétique par exemple) que sur le plan médical. Elle exerce actuellement son activité professionnelle à plein-temps à l’hôpital Lariboisière où elle se consacre à une activité chirurgicale et de recherche clinique sur les nouveaux médicaments de la rétine. Dans le cadre du CERVCO, elle prend en charge plusieurs affections des petits vaisseaux rétiniens telles que la vitréorétinopathie exsudative familiale, les télangiectasies maculaires idiopathiques ou la maladie de Von Hippel Lindau.
Ancien interne des hôpitaux de Paris, François NATAF a ensuite exercé la fonction de Chef de Clinique-Assistant des Hôpitaux puis de praticien hospitalier dans le service de neurochirurgie à l’hôpital Sainte-Anne à Paris de 1997 à 2022. Depuis 2022 il est praticien hospitalier dans le service de Neurochirurgie à l’hôpital Lariboisière à Paris.
Durant cette période, il a contribué au démarrage sur Paris et en France de l’activité de radiochirurgie, initialement et principalement sur les malformations artério-veineuses cérébrales. Il poursuit cette activité associée également à une activité chirurgicale au bloc opératoire.
Un équipement de radiochirurgie de dernière génération (ZAP-X) est en cours d’installation sur le site de l’hôpital Lariboisière. L’activité de radiochirurgie est une UF du service de Neurochirurgie de Lariboisière, sous la direction du Pr Hennequin, radiothérapeute à Saint-Louis. Cet équipement est l’aboutissement d’un projet du GHU Nord associant 7 services dans 3 hôpitaux (Lariboisière, Saint-Louis, Beaujon) en collaboration avec l’Institut de Radiothérapie Hartmann (dans le cadre d’un GCS). L’organisation médicale du GCS intègrera un conseil scientifique.
François NATAF est l’actuel Directeur médical du GCS de radiochirurgie. Les travaux en cours portent notamment sur la radiochirurgie des malformations vasculaires cérébrales (MAV et cavernomes).
Ancien interne des hôpitaux de Paris, le Docteur Anne-Laure Bernat est praticien hospitalier dans le service de Neurochirurgie de l’hôpital Lariboisière. Elle a réalisé un fellowship Clinique à Toronto au Canada. Au sein du département de neurochirurgie, elle prend en charge plus spécifiquement les maladies vasculaires neurochirurgicales, les méningiomes et les adénomes hypophysaires. Son activité de recherche scientifique en collaboration avec les équipes médicales intéressées porte essentiellement sur les maladies vasculaires neurochirurgicales et la gestion des patients victimes d’hémorragie méningée anévrismale. Dans le cadre du CERVCO, elle prend en charge les patients atteints d’anévrismes intra-crâniens, de malformations artério-veineuses et d’angiopathie de MOYA MOYA.
Le Professeur Sébastien Froelich est chef du service de Neurochirurgie de l’Hôpital Lariboisière. Ses travaux de recherche concernent plus particulièrement les affections de la base du crâne et certaines tumeurs comme le chordome. Dans le cadre du CERVCO, il prend plus particulièrement en charge les patients atteints de cavernomes cérébraux et d’angiopathie de moyamoya.
Ancien interne des hôpitaux de Paris et chef de clinique-assistant, Caroline Roos est neurologue, praticien hospitalier temps plein et responsable du Centre d’Urgences des Céphalées de l’hôpital Lariboisière. Elle s’est spécialisée dans la prise en charge des patients souffrant de céphalées primaires et secondaires Elle a participé à de nombreux travaux de recherche et fait partie du comité pédagogique du diplôme Inter-Universitaire Migraine et Céphalées. Dans le cadre du CERVCO, elle prend en charge les patients atteints d’ataxie épisodique et de migraine hémiplégique familiale ou sporadique. Elle est aussi référente pour la prise en charge des patients suivis dans le cadre du CERVCO, souffrant de céphalée.
Le Dr Vittorio Civelli est neuroradiologue interventionnel. Après une formation médicale et spécialisée à Milan (Italie) et un clinicat à l’hôpital Foch (Surennes) et à l’hôpital Lariboisière, il occupe depuis 2016 un poste permanent de Praticien Hospitalier dans le service de neuroradiologie interventionnelle dirigé par le Pr HOUDART où il se consacre à la prise en charge des pathologies vasculaires cérébrales et médullaires (anévrismes, fistules artério-veineuses, AVC, MAV), à la sclérose percutanée des angiomes et des anomalies vasculaires superficielles avec un intérêt clinique et de recherche principalement consacré au traitement de la pathologie sténosante veino-durale (traitement endovasculaire de l’acouphène pulsatiles et de l’hypertension intra-crânienne dite idiopathique), de l’hypotension du LCR, de la maladie de Moya-Moya et des malformations vasculaires superficielles.
Depuis 2014, le Dr Marc-Antoine Labeyrie est praticien hospitalier temps plein au sein du DMU neurosciences à l’hôpital Lariboisière. Il exerce la neuroradiologie interventionnelle et est spécialisé dans la prise en charge des pathologies artérielles et veineuses macrovasculaires de la tête, du cou et du rachis.
Au sein du CERVCO, il participe plus particulièrement aux RCP sur la maladie de Moyamoya et travaille sur le développement de nouvelles variables de phénotypage angiographique de cette maladie.
Ses autres thématiques de recherche sont : 1/ l’évaluation des techniques endovasculaires intracrâniennes innovantes (angioplastie de vasospasme, thrombectomie à la phase aigüe des AVC ischémiques, stenting des sinus latéraux dans l’hypertension intracrânienne idiopathique) ; 2/ L’épidémiologie des causes macrovasculaires rares d’ischémie cérébrale (carotid web, dissections artérielles cervicales et intracrâniennes) ; 3/ L’imagerie cérébrale quantitative (segmentation automatique de l’imagerie cérébrale à la phase aigüe des hémorragies sous arachnoïdiennes).
Professeur des Universités – Praticien Hospitalier, responsable de l’unité de Neuroradiologie Interventionnelle du Service de Neuroradiologie depuis 1997. Cette unité effectue annuellement 800 artériographies cérébrales et 500 interventions endovasculaires de la sphère cérébrale, ORL et médullaire par année. Il s’agit d’un des centres français ayant l’activité la plus importante dans ce domaine. L’activité clinique est supportée par une activité de recherche centrée sur l’évaluation des nouvelles techniques de traitement des anévrysmes intracrâniens, des malformations artério-veineuses cérébrales et de l’athérome des artères cérébrales.
Ancien Interne des hôpitaux de Paris, il a été Assistant Hospitalier Universitaire dans le service de Neurologie de l’hôpital Bichat et Chef de Clinique-Assistant dans le service de Neuroradiologie de l’hôpital Lariboisière. Il est Professeur de Neurologie à l’Université Denis Diderot depuis 2013, membre de l’Unité INSERM 1148 (Laboratory of Vascular Translational Science) et chef du département de Neurologie de l’hôpital Lariboisière. Il partage ses activités de soins entre la neurologie et la neuroradiologie interventionnelle pour la prise en charge des accidents vasculaires cérébraux et notamment des malformations vasculaires cérébrales. Ses travaux de recherche sont centrés sur le développement et l’évaluation de nouveaux traitements à la phase aigüe de l’accident vasculaire cérébral. Pr Mazighi est aussi dans la gouvernance de la FHU Neurovasc 2030, leader du work package 0.
Après un DES de Neurologie à Paris, Isabelle Crassard a effectué un clinicat à l’hôpital Lariboisière (Services de Neurologie et d’Angiohématologie). Elle est actuellement praticien hospitalier dans le département de neurologie de l’hôpital Lariboisière. Elle s’intéresse en particulier aux troubles de la coagulation à l’origine de certains accidents vasculaires cérébraux et aux maladies veineuses cérébrales. Dans le cadre du Centre Maladies Rares, elle prend plus particulièrement en charge les patients ayant une thrombose veineuse cérébrale.
Eric Jouvent est ancien interne et ancien Chef de Clinique – Assistant des hôpitaux de Paris. Il est Professeur des Universités en neurologie à l’Université Paris Diderot et Praticien Hospitalier dans le service de neurologie de l’hôpital Lariboisière. Il s’intéresse à la pathologie vasculaire cérébrale, notamment aux aspects cognitifs et comportementaux des maladies des petites artères cérébrales dont CADASIL.
Ses travaux de recherche portent sur les liens entre l’imagerie et les aspects cliniques dans les maladies des petites artères cérébrales et dans CADASIL, et en particulier sur le rôle du cortex cérébral.
Membre du comité exécutif de la FHU Neurovas2030, Pr Jouvent a un intérêt pour l’innovation et les nouvelles technologies en particulier autour de l’imagerie cérébrale.
Le Docteur Stéphanie Guey, Neurologue, ancien interne des Hôpitaux de Paris et titulaire d’une thèse de sciences en Génétique, est depuis septembre 2022 Maître de Conférences des Universités – Praticien Hospitalier (MCU-PH) au sein du centre de neurologie translationnel (CNVT) Lariboisière et de l’Université Paris Cité.
Au sein du CERVCO, (centre de référence dédié aux maladies vasculaires rares du cerveau et de l’œil), elle consacre son activité clinique et de recherche aux affections cérébrovasculaires rares de l’adulte et plus particulièrement les cavernomatoses cérébrales et les maladies vasculaires cérébrales d’origine génétique, en particulier celles liées aux anomalies des gènes COL4A1 et COL4A2.
Dr Guey a développé une expertise reconnue dans le diagnostic, la compréhension et le suivi de ces pathologies encore peu connues. Elle s’attache à améliorer le parcours de soins des patients et à favoriser le dialogue entre la recherche, les équipes médicales et les familles.
Membre du Conseil scientifique de l’Association COL4A1-A2, Dr Guey est engagée dans une collaboration étroite avec les représentants des patients pour favoriser la diffusion des connaissances, accompagner les familles et faire progresser la recherche dans une approche humaine et collective.
Le Professeur Dominique HERVE a initialement exercé la fonction de Chef de Clinique – Assistant des Hôpitaux au sein du service de neurologie vasculaire de l’hôpital Lariboisière dédiée à la prise en charge en phase aigüe des pathologies vasculaires cérébrales. Depuis Novembre 2006, Dominique HERVE est Praticien Hospitalier temps plein à Lariboisière et son activité clinique est centrée sur la prise en charge des maladies cérébrovasculaires rares. Il est Professeur Associé de Neurologie à l’Université Paris Cité depuis septembre 2025.
Au sein du Centre Neuro-Vasculaire Translationnel (CNVT) de l’hôpital Lariboisière, il est le responsable médical du Centre de Référence des maladies Vasculaires rares du Cerveau et de l’Oeil (CERVCO). Sa mission est pleinement dédiée au développement de ce centre de référence. Dans le cadre du CERVCO, son activité clinique et de recherche concerne principalement l’angiopathie de Moyamoya et les maladies génétiques des petites artères cérébrales (CADASIL et autres leucoencéphalopathies vasculaires génétiques). Il a récemment coordonné la rédaction de recommandations européennes concernant la prise en charge de l’angiopathie de Moyamoya sous l’égide de l’European Stroke Organisation (ESO). Il prend également en charge les patients atteints de cavernomatoses cérébrales et de forme familiale d’anévrysmes cérébraux.
Depuis 2022, il coordonne un groupe de travail européen dédié aux maladies cérébrovasculaires rares (NEUROVASC) au sein du réseau européen de référence pour les maladies vasculaires rares (VASCERN).
Le Professeur Hugues Chabriat est coordonnateur du centre de référence pour les maladies vasculaires rares du cerveau et de l’oeil (CERVCO). Ancien interne des hopitaux d’Ile de France (Cochin Port-Royal) et chef de clinique à la faculté de médecine de Saint-Antoine à Paris, il est professeur de neurologie à l’Université Denis Diderot (Paris VII), chef de service du Centre Neuro-vasculaire Translationnel (CNVT) à l’Hôpital Lariboisiere et co-responsable d’une équipe de recherche au sein de l’unité INSERM U1141.
Ses travaux de recherche concernent plus particulièrement les affections vasculaires rares des petits vaisseaux du cerveau, l’imagerie cérébrale des maladies artériolaires cérébrales et les troubles cognitifs d’origine vasculaire. Il participe avec l’équipe de génétique à l’étude de nouvelles familles de leucoencéphalopathies vasculaire dont l’origine reste à déterminer. Il développe avec d’autres chercheurs les outils d’imagerie pour évaluer, en particulier, l’évolution et les futures thérapeutiques de ces affections.
Il a publié plus d’une centaine d’articles ou de chapitres de livre consacrées aux leucoencéphalopathies vasculaires, à l’imagerie cérébrale des maladies des petits vaisseaux du cerveau et à CADASIL.