Maladies rares
Pour chacune des maladies vasculaires rares du cerveau ou de l’œil rattachées au centre de référence CERVCO, vous trouverez ci-dessous des documents d’information concernant les caractéristiques de la maladie et sa prise en charge.
Pour chacune des maladies vasculaires rares du cerveau ou de l’œil rattachées au centre de référence CERVCO, vous trouverez ci-dessous des documents d’information concernant les caractéristiques de la maladie et sa prise en charge.
Les cavernomes (ou angiomes caverneux) sont des malformations vasculaires constituées de petites cavités gorgées de sang. Il s’agit le plus souvent de lésions bien limitées grossièrement sphériques ayant l’aspect d’une ‘framboise’ à l’œil nu. Leur taille varie de quelques millimètres à quelques centimètres. Les cavernomes sont principalement retrouvés dans le cerveau mais peuvent être localisés dans la moelle épinière et plus rarement en dehors du système nerveux central (rétine, peau, nerfs périphériques, etc…). Les cavernomes cérébraux peuvent se compliquer d’hémorragies cérébrales de petite taille en raison d’une circulation au sein des cavernes à très faible débit.
Dans 40% des cas, on observe à proximité du cavernome une malformation veineuse souvent appelée ‘anomalie veineuse de développement’ qui ne s’accompagne d’aucun symptôme clinique.
On distingue deux formes de cavernomatose cérébrale :
Les cavernomes (ou angiomes caverneux) sont des malformations vasculaires capillaro-veineuses constituées de petites cavités gorgées de sang. Il s’agit le plus souvent de lésions bien limitées grossièrement sphériques ayant l’aspect d’une ‘framboise’ à l’œil nu. Leur taille varie de quelques millimètres à quelques centimètres. Les cavernomes sont principalement retrouvés dans le cerveau mais peuvent être localisés dans la moelle épinière et plus rarement en dehors du système nerveux central (rétine, peau, nerfs périphériques, etc…). Les cavernomes cérébraux peuvent se compliquer d’hémorragies cérébrales de petite taille en raison d’une circulation au sein des cavernes à très faible débit.
Dans 40% des cas, on observe à proximité du cavernome une malformation veineuse souvent appelée ‘anomalie veineuse de développement’ qui ne s’accompagne d’aucun symptôme clinique.
On distingue deux formes de cavernomatose cérébrale :
La prévalence des cavernomes cérébraux est estimée à environ 0,5% dans la population générale. On retrouve une prévalence identique chez les enfants. Les cavernomes représenteraient entre 5 et 10% de l’ensemble des malformations vasculaires cérébrales.
Vingt pour cents environ des patients ayant un diagnostic de cavernome sont atteints d’une forme génétique de l’affection. A ce jour environ 430 familles non apparentées ont été identifiées en France. Les cavernomes sont observés à tous les âges de la vie mais les formes découvertes dans l’enfance (avant l’âge de 18 ans) représentent au moins 25% des cas.
La plupart des cavernomes restent asymptomatiques, leur découverte est alors fortuite. Ils deviennent symptomatiques généralement entre la troisième et la cinquième décade. Les symptômes les plus fréquents comprennent des crises d’épilepsie et des symptômes neurologiques focaux en rapport avec la survenue d’hémorragies cérébrales ou la compression locale du tissu cérébral par la malformation.
L’histoire naturelle des cavernomes reste mal connue. Certains auteurs estiment cependant que seulement 5% des sujets ayant un cavernome isolé présenteront un jour des manifestations cliniques en rapport avec cette lésion. Certains facteurs comme le nombre, la localisation et la taille des cavernomes influenceraient par contre le risque de survenue de ces manifestations.
L’épilepsie est la manifestation la plus fréquente au moment du diagnostic (50%). Le risque épileptique est particulièrement lié à la localisation des cavernomes. Il est plus élevé lorsque les cavernomes sont situés à proximité du cortex cérébral. Il peut s’agir de crises d’épilepsie partielles ou secondairement généralisées. Le plus souvent il s’agit d’une crise unique ou de crises répétées mais peu nombreuses qui conduiront à la mise en place d’un traitement antiépileptique.
Les hémorragies cérébrales sont le plus souvent de faible abondance et peu symptomatiques. Le risque de saignement est plus élevé chez les patients symptomatiques en particulier chez ceux ayant déjà présenté une hémorragie. A titre d’exemple, chez les enfants et les adultes de moins de 25 ans porteur de cavernome, le risque de saignement a été évalué à 1.6% par an globalement, à 8% par an en cas de cavernome symptomatique et à 0.2% par an en cas de découverte fortuite. Le saignement peut survenir à l’intérieur du cavernome contribuant à l’augmentation de taille de la malformation ou s’étendre, de façon limitée, directement au sein du tissu cérébral sous la forme d’une fine couronne. Plus rarement, l’hémorragie est volumineuse et s’accompagne de symptômes neurologiques d’installation brutale (céphalées, vomissements, paralysie d’un hémicorps, troubles du langage, troubles visuels,…).
Les conséquences de l’hémorragie varient en fonction de la localisation du cavernome. L’atteinte du tronc cérébral est la plus grave, elle peut être responsable de symptômes variés (troubles de la vigilance, vision double, troubles de l’équilibre et de la coordination, etc…) et peut parfois aboutir à la mise en jeu du pronostic vital. La prise d’un traitement anticoagulant augmente le risque hémorragique. Le rôle de la grossesse comme facteur aggravant n’est pas clairement établi.
L’augmentation de volume du cavernome est liée à la répétition des microhémorragies ou à la croissance même de la malformation. Elle s’accompagne parfois de symptômes neurologiques focaux dont la nature et la sévérité dépendent essentiellement de leur localisation (hémiplégie, troubles visuels…).
La survenue de céphalées chez des patients ayant un ou plusieurs cavernomes peut être d’interprétation délicate en l’absence d’hémorragie importante.
Pour les cavernomes familiaux, la survenue de manifestations cliniques apparaît beaucoup plus fréquente que pour les formes sporadiques et concernerait près de 50% des patients.
Les symptômes sont identiques à ceux rapportés dans les formes sporadiques: crises d’épilepsie, hémorragies cérébrales, déficits neurologiques et céphalées. Les premières manifestations cliniques sont plus précoces et surviennent le plus souvent avant l’âge de 30 ans. La fréquence des hémorragies apparaît aussi plus élevée. Elle est estimée à environ 4% par année et par patient.
Le pronostic fonctionnel au cours des formes familiales semble moins lié au nombre de cavernomes qu’à leur localisation. En l’absence d’atteinte du tronc cérébral, le pronostic à long terme semble favorable avec une autonomie préservée chez environ 80% des patients.
Les cavernomatoses cérébrales d’origine génétique s’accompagnent parfois de manifestations extraneurologiques (cavernomes rétiniens et localisations cutanées en particulier). La fréquence d’une association cérébrale et rétinienne est estimée à 5 % de l’ensemble des patients ayant une forme héréditaire de cavernomes. Les cavernomes rétiniens sont en général unilatéraux, le plus souvent asymptomatiques et non évolutifs. Ils peuvent être observés isolément, sans atteinte cérébrale associée. Les lésions cutanées classiquement décrites sont très particulières et constamment associées à une atteinte centrale : il s’agit de malformations capillaires, de malformations cutanées capillaro-veineuses hyperkératosiques et de malformations veineuses. Dans environ 90% des cas, ces malformations vasculaires cutanées sont observées chez des patients porteurs d’une anomalie du gène KRIT1 (voir chapitre suivant). Enfin, un phénotype lié à l’atteinte du gène CCM3 et associant de multiples lésions de la dure-mère proches de méningiomes à une cavernomatose cérébrale a été rapportée dans quelques familles.
L’origine précise des cavernomes isolés (sporadiques) demeure indéterminée. Dans les formes familiales, trois gènes des cavernomes appelés CCM (Cerebral Cavernomatous Malformations) ont été identifiés : le gène KRIT1 ou CCM1 et le gène MGC4607 ou CCM2 situés sur le chromosome 7 le gène PDCD10 ou CCM3 situé sur le chromosome 3.
Dans environ 50% des cas, la mutation siège dans le gène CCM1, dans 15% des cas dans le gène CCM2 et dans 10% des cas dans le gène CCM3.
Chez 5 % seulement des patients ayant une cavernomatose familiale, le criblage de ces 3 gènes ne met en évidence aucune mutation. Ces formes « sans mutation identifiée» sont pourtant selon toute vraisemblance des formes génétiques et pourraient être expliquées par : 1) l’existence d’autres gènes CCM qui ne sont pas encore identifiés, 2) l’existence de mutations qui ne peuvent être détectées actuellement par le seul séquençage des régions codantes d’un des 3 gènes CCM, 3) par la possibilité de mosaïques (certaines cellules contiennent la mutation, d’autres ne la présentent pas).
Chez 40% environ des patients ayant une cavernomatose multiple mais n’ayant pas d’histoire familiale, le criblage de ces 3 gènes ne met en évidence aucune mutation. Les hypothèses mentionnées dans le paragraphe précédent restent valables mais cette situation suggère également que les lésions cérébrales identifiées à l’imagerie pourraient différer dans certains cas de cavernomes authentiques.
Dans certains cas, la mutation peut apparaître de novo chez un patient dont aucun des 2 parents n’est malade. Le patient présente alors les signes habituels d’une cavernomatose multiple et peut transmettre à sa descendance la mutation responsable de la maladie.
L’imagerie par résonance magnétique (IRM) du cerveau est l’examen de référence pour le diagnostic des cavernomes cérébraux. La séquence écho de gradient (T2*) est de loin la plus sensible pour identifier des cavernomes en raison de sa grande sensibilité pour détecter les traces de saignements dans le tissu cérébral. L’IRM permet d’autre part, non seulement de poser le diagnostic, mais aussi de dater l’hémorragie, de surveiller l’évolutivité du ou des cavernomes et de mettre en évidence une anomalie veineuse de développement associée.
Une classification en 4 catégories a été proposée. Elle est basée sur l’apparence en IRM du cavernome (hyperintense, hypointense) sur différentes séquences (T1, T2, écho de gradient). A chaque type correspond une information concernant les caractéristiques du cavernome (type I : saignement récent, type II : lésions hétérogènes avec saignements et thromboses d’âges variables, type III : saignement ancien, type IV : aspect évoquant un cavernome en voie de constitution)
Les études de suivi des cavernomes familiaux ont confirmé le caractère dynamique de ces malformations en imagerie cérébrale. L’évolutivité des cavernomes peut se traduire par l’apparition de nouvelles lésions ou par des modifications de leurs caractéristiques (en particulier de leur taille). La mise en évidence d’une prolifération endothéliale en périphérie des cavités vasculaires suggère que des phénomènes d’angiogenèse pourraient être impliqués dans l’augmentation du volume de certains cavernomes.
Les cavernomes ne sont pas visualisés avec les techniques d’angiographie (angioscanner, angiographie par résonance magnétique ou artériographie cérébrale) car la circulation au sein des « cavernes » (cavités composant le cavernome) se fait à bas-débit et les vaisseaux alimentant la malformation sont de très petites tailles. L’imagerie des vaisseaux du cerveau est parfois nécessaire pour éliminer un autre type de malformation vasculaire. Cet examen révèle parfois une anomalie veineuse de développement associée au cavernome.
L’identification des gènes CCM rend aujourd’hui techniquement possible le criblage de ces 3 gènes en pratique hospitalière. Dans la très grande majorité des cas, les mutations identifiées entraînent l’apparition d’un codon stop prématuré ou une délétion partielle ou complète d’un des 3 gènes CCM.
La sensibilité du criblage chez un sujet atteint d’une cavernomatose familiale est d’environ 94 % (voir supra) alors qu’elle n’est que de 57 % pour un cas sporadique avec lésions multiples.
Une fois la mutation identifiée chez un patient, la sensibilité du test atteint 100 % pour ses apparentés.
La décision de réaliser un test génétique doit être précédée d’une analyse préalable du bénéfice réel pour le sujet de ce test, particulièrement lorsqu’il s’agit d’un sujet asymptomatique. De fait l’indication de ces tests apparaît très variable et varie dans différentes situations (voir chapitre suivant).
Les formes génétiques de cavernomatose cérébrale (CCM) sont autosomiques dominantes. La maladie affecte aussi bien les hommes que les femmes avec une proportion de sujets atteints voisine de 50 % dans la descendance d’un sujet atteint.
La très grande majorité des patients ayant une cavernomatose d’origine génétique ont des lésions multiples en IRM cérébrale.
Pour les individus asymptomatiques, le dépistage n’est pas réalisé avant l’âge de 18 ans.
Les tests moléculaires n’ont pas d’indication chez les patients ne présentant qu’une seule lésion en IRM (séquence en écho de gradient) et n’ayant pas d’histoire familiale (forme sporadique).
Pour répondre à la demande des cliniciens et aux demandes de conseil génétique, l’Unité de génétique de l’hôpital Lariboisière a mis en place en routine une procédure diagnostique.
La prise en charge d’un cavernome cérébral doit faire l’objet d’une discussion au cas par cas.
Différentes options thérapeutiques peuvent être choisies :
Dans tous les cas, la prescription d’un traitement anticoagulant (tels que les antivitamines K ou l’héparine) doit être réservée à des indications formelles (thrombophlébite des membres inferieurs, embolie pulmonaire, etc…). . La prise d’antiaggrégants plaquettaires (dont l’aspirine et certains anti-inflammatoires) à visée antalgique ou antipyrétique n’est par ailleurs pas recommandée. Son utilisation dans les autres indications de ce traitement doit être maintenue en raison de données très rassurantes concernant le devenir de patients porteurs de cavernomes et traités par antiaggrégant plaquettaire. Enfin, en cas de cavernome hemisphérique proche du cortex, l’éviction des situations où la survenue d’une épilepsie généralisée serait catastrophique doit être recommandée (plongée sous-marine, escalade non assurée, baignade non surveillée, parachutisme).
Ce document a été réalisé par ORPHANET en collaboration avec le CERVCO (D. Hervé, E. Tournier-Lasserve, H. Chabriat), le centre de référence des pathologies neurovasculaires malformatives (Professeur Pierre Lasjaunias †) et l’Association Cavernomes Cérébraux.
Source: Le Cavernome, Encyclopédie Orphanet Grand Public
www.orpha.net/data/patho/Pub/fr/CavernomeCerebral-FRfrPub1072.pdf
Un cavernome cérébral, aussi appelé angiome caverneux, est une malformation des vaisseaux sanguins (qui sont anormalement dilatés) située au niveau du cerveau.
Cette malformation ne provoque le plus souvent aucun symptôme, mais elle est parfois à l’origine de divers troubles neurologiques (maux de tête, épilepsie, troubles de la vision et de la sensibilité au niveau des membres…).
La prévalence du cavernome cérébral (nombre de personnes atteintes de cette malformation dans une population à un moment donné) n’est pas connue précisément. De plus, très peu de personnes atteintes présentent des symptômes, et beaucoup d’entre elles ne sauront jamais qu’elles ont un cavernome.
Dans sa forme la plus fréquente, non génétique, elle est comprise entre 1 cas sur 1000 et 1 cas sur 200 selon les études. Ces formes ne sont donc pas rares. En revanche, les formes familiales le sont.
Le cavernome cérébral touche aussi bien les hommes que les femmes, quelle que soit leur origine. Il se manifeste le plus souvent entre l’âge de 20 et 40 ans, mais il peut entraîner des symptômes dès l’enfance ou l’adolescence.
La cause exacte de cette malformation des vaisseaux (malformation vasculaire) est mal connue, mais il s’agit d’une anomalie locale du développement des vaisseaux, qui survient
Le cavernome cérébral avant ou après la naissance. Le cavernome est constitué de vaisseaux minuscules (capillaires) très dilatés, entortillés et regroupés sous formes de cavités ou de « cavernes » juxtaposées (d’où le nom de cavernome). Le cavernome ressemble en fait à une pelote de petits vaisseaux ayant la forme d’une mûre ou d’une framboise, dont la taille varie de quelques millimètres à plusieurs centimètres (figure 1).
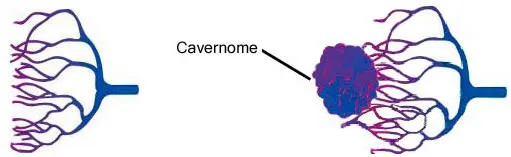
Figure 1
A gauche, la constitution normale du réseau de vaisseaux fins (capillaires). A droite, un cavernome constitué de capillaires dilatés formant des lobes.
Dans les formes familiales (environ 20 %), la malformation des vaisseaux est associée à l’anomalie (mutation) d’un gène. Un gène équivaut à un « code » qui donne les instructions pour produire une protéine. Les protéines ont des fonctions très variées : elles contribuent au fonctionnement normal de chaque cellule, et plus globalement, de l’organisme. Dans les formes familiales, le cavernome est héréditaire, c’est-à-dire que la maladie peut se transmettre des parents aux enfants. Le mécanisme exact par lequel l’anomalie génétique entraîne l’apparition d’un cavernome cérébral est encore mal connu. Cependant, les gènes en cause dans la maladie , appelés CCM1, CCM2 et CCM3, semblent impliqués dans la formation des vaisseaux sanguins chez l’embryon. Ces formes familiales se caractérisent souvent par la présence de plusieurs cavernomes et entraînent un plus grand risque de complications.
Non, le cavernome cérébral n’est pas contagieux.
Dans 90 % des cas, le cavernome cérébral n’entraîne aucun symptôme et reste « silencieux » pendant toute la vie (on dit qu’il est « asymptomatique »). Il est alors souvent découvert par hasard, au cours d’un examen IRM (imagerie par résonance magnétique) effectué pour une tout autre raison.
Cependant, dans 10 % des cas, le cavernome provoque divers symptômes (on dit qu’il est « symptomatique »). Le plus souvent, les premiers symptômes surviennent entre l’âge de 20 et 40 ans. Il peut s’agir de crises d’épilepsie (40 à 70 %), de maux de tête (10 à 30 % des cas), ou d’autres troubles neurologiques (35 à 50 %).
Les symptômes varient considérablement d’un malade à l’autre, selon qu’il y ait un ou plusieurs cavernomes. Ils varient également selon l’emplacement et la taille du ou des cavernomes.
Les crises d’épilepsie constituent le symptôme le plus fréquent. Elles touchent 40 à 70 % des personnes ayant un cavernome symptomatique.
Dans près de la moitié des cas, l’épilepsie est la première manifestation du cavernome.
Elle se manifeste surtout par des « crises » récurrentes, se répétant plus ou moins fréquemment. Ces crises sont dues à une activité anormale des cellules nerveuses du cerveau, les neurones.
De manière générale, les neurones communiquent entre eux et avec le reste du corps par le biais de décharges électriques qui constituent les messages nerveux. Les crises d’épilepsie surviennent lorsqu’un groupe de neurones libère au même moment des décharges électriques de façon soudaine et anormale, un peu comme un orage. Le terme « épilepsie » vient du grec et signifie « prendre par surprise, attaquer ».
Ces décharges électriques peuvent avoir lieu dans des zones du cerveau qui ont diverses fonctions. Les manifestations des crises sont donc variables : mouvements ou convulsions (secousses musculaires, tremblements, raideurs), troubles de la sensibilité et des sens (fourmillements, engourdissements, hallucinations auditives, visuelles…), troubles psychiques (peur panique, troubles de la mémoire, confusion, perte de connaissance, absences) ou encore salivation excessive, perte d’urine… Les crises peuvent toucher tout le corps avec perte de connaissance (crises généralisées), ou plus souvent une partie limitée ou une moitié du corps (crises partielles).
Chez les personnes qui ont un cavernome, il peut s’agir d’une crise d’épilepsie isolée ou plus souvent de crises répétitives, sévères, parfois résistantes aux médicaments antiépileptiques. La crise d’épilepsie peut révéler un saignement local du cavernome.
Le cavernome peut entraîner des troubles neurologiques divers, comme des vertiges, une vision double (diplopie) ou une diminution brutale de la vue, des troubles de la sensibilité d’un membre (fourmillements, engourdissement…), ou encore une faiblesse voire une paralysie d’un côté du corps. La nature des symptômes dépend de la localisation du caver-nome dans le cerveau. Des troubles de l’audition, du langage ou de la parole (difficultés à articuler, à trouver ses mots…) peuvent également apparaître. De nombreuses personnes atteintes se plaignent également de maux de tête (ou céphalées). Les céphalées sont très fréquentes dans la population générale et il est souvent difficile d’affirmer chez ces patients que le cavernome en est la cause. En cas de céphalée inhabituelle, violente ou particulièrement intense, il est nécessaire de consulter un médecin en urgence pour rechercher des signes de souffrance du cerveau (souffrance cérébrale) liée ou non au cavernome.
Dans certains cas exceptionnels, les personnes atteintes présentent des pertes de conscience, voire même un coma profond.
Tous ces symptômes peuvent être temporaires ou permanents.
Il apparaît que certaines personnes qui ont un cavernome cérébral présentent également des symptômes non neurologiques. Ainsi, des taches rouges (qui ressemblent à des «taches de vin» ou angiomes plans) peuvent être présentes sur la peau. Elles correspondent à des malformations des vaisseaux sanguins au niveau de la peau (cutanés). Des malformations des vaisseaux au niveau de la rétine (surface du fond de l’œil qui reçoit les images) ont également été observées mais n’entraînent souvent aucun symptôme. Ces manifestations supplémentaires concernent le plus souvent les personnes atteintes de la forme familiale de la maladie.
Les symptômes observés chez les personnes qui ont un cavernome cérébral sont dus, soit au cavernome lui-même, soit aux « hémorragies cérébrales ». En effet, les parois des cavités qui constituent le cavernome sont fragiles et se rompent facilement, entraînant un épanchement de sang qui peut endommager les structures cérébrales alentours. Cela étant, l’hémorragie qui suit la rupture des cavités est généralement très peu abondante, car le sang circule avec un débit faible au sein du cavernome. De ce fait, la survenue d’une hémorragie cérébrale importante qui entraînerait une perte de la conscience, voire un coma profond, est exceptionnelle (à la différence de ce qui peut se produire avec d’autres malformations des vaisseaux du cerveau).
Parallèlement, le cavernome dont la taille augmente parfois au fil du temps peut comprimer les zones du cerveau qui l’entourent et ainsi être à l’origine de symptômes neurologiques. Les saignements ou la compression entraînent des symptômes similaires, temporaires ou permanents. Chaque région du cerveau étant responsable de fonctions spécifiques, le type de symptômes et leur localisation (yeux, bras, jambe…) varient considérablement selon la région du cerveau touchée.
Quant à l’épilepsie, elle est due à « l’irritation » de certaines zones du cerveau au contact du cavernome.
La fréquence à laquelle surviennent les symptômes neurologiques chez les patients qui ont un ou des cavernomes est mal connue. Cependant, il est probable que parmi les patients qui ont un cavernome unique, seule une minorité présentera un jour des symptômes neurologiques. Pour les personnes qui présentent des symptômes, les manifestations peuvent soit se stabiliser (voire régresser), soit s’aggraver avec le temps.
Les cavernomes familiaux sont plus souvent symptomatiques que les cavernomes non familiaux (sporadiques), car ils sont souvent multiples et de nouvelles lésions peuvent apparaître avec l’âge.
L’évolution de l’état de santé du malade dépend surtout du risque de saignement du cavernome et de sa localisation dans le cerveau. Il est toutefois exceptionnel qu’une hémorragie due à un cavernome cérébral soit importante et à l’origine du décès du malade. Après une première hémorragie, le risque d’un deuxième saignement augmente et est évalué à environ 4 % par an. Cela signife que sur 100 malades qui ont une hémorragie cérébrale, 4 ressaigneront dans l’année qui suit.
La sévérité de l’épilepsie associée à un cavernome est très variable d’une personne à l’autre et peut même varier au cours du temps chez une même personne.
Contrairement à ce que peuvent craindre certaines personnes, le cavernome n’est pas un cancer et il n’y a aucun risque de propagation au reste du corps.
Le diagnostic du cavernome n’est pas toujours évident, surtout si les premiers symptômes sont « légers » : maux de tête, crise d’épilepsie isolée… Si le médecin soupçonne la présence d’une lésion cérébrale, une IRM (imagerie par résonance magnétique), ou parfois un scanner, sont effectués. Ces examens indolores permettent de visualiser le cerveau et de mettre en évidence la présence du ou des cavernome(s) (figure 2).
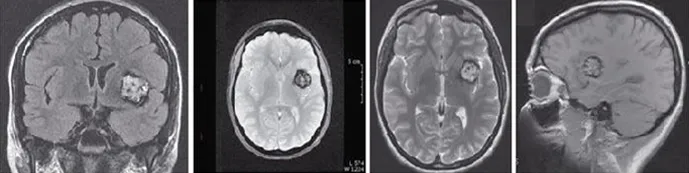
Figure 2
Visualisation d’un cavernome volumineux typique sur différentes images chez un même malade.
Dans certains cas, une angiographie cérébrale peut être faite. C’est un examen qui permet d’observer les vaisseaux sanguins par radiographie, après avoir injecté dans le sang un produit dit « de contraste » qui permet de mieux visualiser les vaisseaux. Cette technique n’est pas efficace pour détecter les cavernomes cérébraux car les vaisseaux concernés sont trop fns, elle n’est donc pas utile si le diagnostic a déjà été fait. En cas de doute sur le diagnostic à l’IRM, elle permet de détecter d’autres maladies des artères ou des veines (anévrysme congénital, malformations artério-veineuses…) pouvant être à l’origine des mêmes symptômes.
Après une crise d’épilepsie, le médecin peut demander des analyses de sang pour déterminer si la crise est due à un taux sanguin anormal de sucre, de calcium, de sodium par exemple, avant d’effectuer tout autre examen.
En cas d’épilepsie, un électroencéphalogramme (EEG) peut aussi être réalisé. Il consiste à enregistrer l’activité électrique du cerveau qui est parfois perturbée en cas d’épilepsie (même en dehors des crises). C’est un examen indolore qui est réalisé en plaçant des électrodes sur le cuir chevelu.
Les symptômes provoqués par les cavernomes cérébraux peuvent être confondus avec les symptômes d’autres affections qui endommagent le cerveau. Il peut s’agir d’une hémorragie cérébrale liée à d’autres malformations vasculaires (malformations artério-veineuses par exemple). Il peut aussi s’agir d’un infarctus cérébral (AVC pour Accident Vasculaire Cérébral), lorsqu’une artère se bouche et qu’une zone du cerveau est soudainement privée d’irrigation (le sang n’y circule plus ou mal), ou encore de certaines tumeurs du cerveau,…
Des techniques spéciales d’IRM permettent de distinguer ces différentes maladies.
Il y a deux formes de cavernomes cérébraux : une forme non héréditaire ou sporadique (la maladie survient « par hasard » chez une personne sans qu’aucun membre de sa famille n’en soit affecté) et une forme familiale (au moins deux personnes de la famille sont atteintes). Les cas « familiaux » sont caractérisés par la présence de plusieurs cavernomes, alors que dans les cas non héréditaires, il n’y a généralement qu’un cavernome.
La forme familiale est due à l’anomalie des gènes qui jouent un rôle dans la formation des vaisseaux : les gènes CCM1, CCM2 et CCM3. Les chercheurs estiment que cette forme concerne environ 20 % des cavernomes cérébraux. Cette forme de la maladie se transmet de de manière héréditaire d’une génération à l’autre (transmission autosomique dominante), ce qui signifie qu’une personne atteinte a un risque sur deux de transmettre la maladie à ses enfants à chaque grossesse. La maladie affecte de manière identique les garçons et les filles (figure 3).
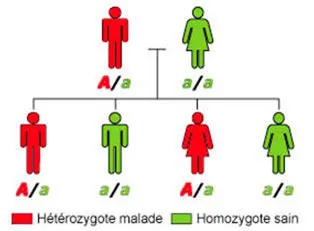
Figure 3
Sur ce schéma, le père possède un gène muté (A) responsable de la formation de cavernomes. Il a un risque sur deux de transmettre ce gène à ses enfants, qui risquent à leur tour développer la maladie.
Cependant, toutes les personnes porteuses du gène muté ou anormal ne développeront pas la maladie. En fait, seules 60 % d’entre elles seront concernées par un cavernome entraînant des symptômes, les 40 % restants n’ayant jamais aucune manifestation.
Chez un malade qui n’a pas dans sa famille d’autre personne atteinte et qui ne présente qu’un seul cavernome à l’IRM, le cavernome est vraisemblablement sporadique (non familial) et il n’y a pas de risque de transmission aux enfants. Les autres membres de sa famille n’ont pas plus de risque d’avoir un cavernome cérébral que n’importe quelle personne de la population générale.
Il existe des cas où un malade n’a pas de membre de sa famille atteint connu et présente plusieurs cavernomes; dans ce cas il existe un risque de transmission à sa descendance, car la présence de plusieurs cavernomes est plus fréquente dans les formes familiales de la maladie.
Comme il n’est pas toujours évident de savoir si le cavernome est familial ou non, il est conseillé, dans tous les cas, de consulter un spécialiste dans un centre de génétique médicale pour une évaluation précise du risque de transmission dans la famille.
Dans le cas des cavernomes cérébraux familiaux, il est possible de dépister cette maladie chez les membres de la famille qui ne présentent pas de symptômes, par examen IRM du cerveau ou par examen génétique à la recherche de la mutation présente chez le membre de la famille malade, lorsqu’elle est connue.
Cependant, dans la mesure où un tel dépistage ne modifie pas la prise en charge de la personne, il n’est pas recommandé. En effet, lorsqu’il ne donne pas de symptômes, le traitement du cavernome est exceptionnel, et les mesures préventives recommandées aux personnes sans aucun symptôme sont simples et peu contraignantes (voir Traitement).
Le bénéfice d’un dépistage chez l’adulte doit donc être soigneusement considéré avant toute décision. Ce dépistage n’est pas recommandé chez les enfants.
Dans les familles où plusieurs personnes atteintes ont des symptômes sévères et pour lesquelles l’anomalie génétique en cause a été identifiée, un diagnostic prénatal est possible. Il consiste à déterminer si l’enfant à naître est porteur du gène anormal. A sa demande, le couple est adressé à une consultation multidisciplinaire agréée de diagnostic prénatal. La réalisation d’un diagnostic prénatal fait l’objet d’une discussion au cas par cas, après avoir donné au couple toutes les informations connues sur cette maladie, en particulier son caractère très variable (40 % des porteurs de la mutation ne développent pas de symptômes durant leur vie entière). Le diagnostic prénatal est en pratique rarement demandé.
Les deux techniques de prélèvements de cellules du fœtus utilisées sont l’amniocentèse et le prélèvement des villosités choriales.
L’amniocentèse permet d’examiner les cellules qui flottent dans le liquide dans lequel baigne le fœtus (liquide amniotique). Le prélèvement se fait à l’aide d’une seringue à travers la paroi abdominale. Cet examen est proposé vers la 15e semaine de grossesse.
Le prélèvement des villosités choriales a l’avantage de se pratiquer plus tôt au cours de la grossesse : il consiste à prélever une très petite quantité de tissu à l’origine du placenta (le trophoblaste) à l’extérieur de l’enveloppe où le fœtus se développe. Le test est généralement réalisé vers la 11e semaine de grossesse.
Ces examens entraînent un faible risque de fausse couche, différent selon le choix de la technique de prélèvement, qu’il convient de discuter en consultation de génétique au préalable. Le résultat est connu en une ou deux semaines.
La prise en charge d’un cavernome cérébral est adaptée à chaque cas particulier, en fonction des manifestations éventuelles. Dans la plupart des cas, lorsqu’il n’y a aucun symptôme, aucun traitement n’est nécessaire. Des mesures préventives simples suffisent : éviter les sports pouvant entraîner des traumatismes crâniens (boxe, sports de compétition…), éviter la prise de médicaments qui favorisent les saignements lorsque cela n’est pas absolument nécessaire (par exemple, remplacer l’aspirine par du paracétamol en cas de fièvre).
Seuls certains cavernomes sont opérés : il s’agit de ceux qui saignent régulièrement et, dans certains cas, de ceux qui entraînent des crises d’épilepsie. L’ablation (exérèse) totale de la lésion vise à diminuer le risque de complications. Cependant, l’intervention chirurgicale n’est pas dénuée de risque.
Certains cavernomes sont inopérables, en raison de leur localisation particulière dans le cerveau (régions profondes, vitales ou très importantes). Car ces régions risqueraient d’être endommagées lors de l’intervention.
En cas de cavernome inopérable ou très petit, des séances de radiochirurgie (par exemple de type « Gamma knife ») peuvent être réalisées. La radiochirurgie consiste à utiliser la concentration de différents faisceaux de rayons (photons, rayons gamma…). Ces rayons traversent les tissus et détruisent les cellules visées. Les séances durent de 20 minutes à une heure et sont totalement indolores. Cependant, l’efficacité de la radiochirurgie est très controversée. De plus, cette technique n’est pas dénuée de risques de complications. Ce risque augmente dans les cas où une autre malformation des vaisseaux sanguins (anomalie veineuse) est associée. Par ailleurs, certains cavernomes peuvent être provoqués par la radiochirurgie (cavernomes radio-induits).
En cas d’épilepsie (avant ou après l’opération quand elle subsiste), des médicaments antiépileptiques sont parfois donnés au malade pour diminuer le nombre de crises.
De nombreux médicaments sont disponibles, parmi lesquels la carbamazépine, le phénobarbital, ou encore le valproate de sodium. Leur efficacité est très variable d’un malade à l’autre.
Chez certaines personnes atteintes, les crises d’épilepsie ne cèdent pas avec les médicaments (on parle de pharmaco-résistance). Dans certains de ces cas, la chirurgie est proposée pour améliorer le contrôle de l’épilepsie.
Les récents progrès des techniques de neurochirurgie (dont la neuronavigation qui est la chirurgie assistée par ordinateur) ont permis de réduire les risques liés à l’opération du cerveau. Le taux de mortalité due à ces opérations est inférieur à 4 %. Cependant, dans un petit nombre de cas, l’intervention chirurgicale peut provoquer des déficits neurologiques permanents (perte de sensibilité d’un membre, troubles de la vision…), qui surviennent
lorsque certaines zones du cerveau sont endommagées au cours de l’opération. Dans tous les cas, avant l’intervention, le chirurgien expose au malade les risques propres à chaque cas particulier, qui dépendent de la localisation et de la taille du cavernome.
Les médicaments antiépileptiques peuvent avoir des effets secondaires (somnolence, vertiges, troubles digestifs…), mais ils sont généralement bien tolérés. Un médicament antiépileptique ne doit jamais être arrêté ni remplacé par un autre sans l’avis du médecin. De plus, il est indispensable de demander l’avis du médecin avant de prendre un autre médicament, quel qu’il soit, car les antiépileptiques peuvent modifier l’action des autres médicaments (risque de surdosage ou d’inefficacité).
Un soutien psychologique est souvent indispensable, à toutes les étapes de la maladie, tant pour le malade que pour sa famille.
L’annonce du diagnostic est un moment difficile, dans la mesure où il s’agit d’une lésion située dans le cerveau, zone fragile et au niveau de laquelle les interventions sont délicates.
Par ailleurs, dans les cas familiaux, la peur de transmettre (ou d’avoir transmis) la maladie à ses enfants est souvent intense et associée à un sentiment de culpabilité.
Lorsqu’une personne adulte qui a un risque d’avoir la maladie demande un dépistage, le soutien psychologique est important pour l’aider aux différentes étapes du test (définir ses motivations, décider de faire ou non le test, accueillir le résultat).
Enfn, l’évolution du cavernome étant imprévisible, les patients porteurs de cavernomes ou les membres de la famille qui ne savent pas s’ils sont atteints peuvent s’inquiéter lors de l’apparition de symptômes neurologiques, même peu importants (maux de tête, picotements dans un membre…), de peur d’une complication en rapport avec le cavernome (en particulier d’une hémorragie cérébrale).
Il n’y a pas de recommandation particulière, mais il est toutefois nécessaire d’être attentif et de réagir vite en cas de symptômes inhabituels. Ainsi, une hémorragie cérébrale peut se traduire par une crise d’épilepsie, un mal de tête soudain, des nausées, des troubles de la vision, des difficultés à bouger un membre (il devient par exemple difficile d’écrire)… Dans ce cas, il est recommandé de consulter son médecin rapidement.
Le suivi des personnes qui ont un cavernome cérébral est assuré lors de consultations hospitalière de neurologie ou de neurochirurgie. Lorsque le cavernome n’entraîne aucun symptôme, la surveillance est réalisée avec l’aide d’une IRM tous les ans ou tous les 2 ans. Elle a pour objectif d’évaluer les modifications éventuelles du cavernome (saignement passé inaperçu, augmentation de volume…).
En cas d’urgence ou de tout problème de santé, il est important de signaler au personnel soignant l’existence du cavernome et les traitements en cours (surtout les antiépileptiques) et leur dose. Cette précaution est essentielle pour détecter rapidement les éventuelles complications du cavernome cérébral et pour éviter la prescription de traitements anticoagulants qui augmentent le risque d’hémorragie cérébrale.
Non, à ce jour, il n’existe aucun moyen de prévenir la survenue des cavernomes cérébraux.
Les conséquences des cavernomes cérébraux symptomatiques (5 % à 15 % des cavernomes) sur la vie quotidienne varient considérablement d’une personne à l’autre. Elles peuvent être insignifiantes ou au contraire importantes, en fonction de la sévérité des symptômes.
Les personnes qui ont des crises d’épilepsie sévères et répétitives souffrent des répercussions de leur maladie sur la vie quotidienne et sociale, car l’épilepsie peut être source de rejet (elle est parfois perçue comme une maladie mentale), de limitations dans la vie quotidienne (dans le sport, la conduite automobile)…
En ce qui concerne les troubles neurologiques, ils perturbent parfois des fonctions essentielles comme la marche, la parole, la vision, et peuvent donc être très handicapants. Ils peuvent nécessiter la remise en question (temporaire ou définitive) de l’activité professionnelle, ou du moins une réorientation ou une réorganisation du temps de travail. Le caractère imprévisible de la maladie est parfois difficile à vivre.
Cependant, le pronostic à long terme est relativement favorable, avec dans la grande majorité des cas (plus de 80 %), une conservation de l’autonomie. Le diagnostic de plus en plus précoce des cavernomes cérébraux, la surveillance et les progrès en neurochirurgie tendent à améliorer la qualité de vie des personnes atteintes en évitant ou en limitant le risque de handicap.
Il est possible d’avoir des enfants lorsqu’on est porteuse d’un cavernome cérébral. Cependant, il est nécessaire d’informer son médecin de tout désir d’enfant, ou lorsque l’on est déjà enceinte, afin qu’il évalue les risques pour la mère et le futur enfant et qu’il puisse assurer un suivi adapté.
L’identification récente des trois gènes impliqués dans les formes familiales de cavernomes cérébraux est une piste intéressante pour la compréhension des mécanismes en jeu dans la malformation des vaisseaux.
Les recherches actuelles visent à étudier à grande échelle sur des groupes de malades, la corrélation entre le type d’anomalie génétique et le type et le nombre de cavernomes.
L’étude de modèles animaux (souris) présentant des mutations génétiques comparables est un moyen prometteur pour comprendre plus en détail les aspects génétiques de la maladie et les mécanismes en cause. Cela permettra peut-être d’identifier de nouveaux traitements qui réduiraient le risque de saignement des cavernomes cérébraux, de médicaments qui permettraient d’augmenter l’efficacité d’autres traitements (radiochirurgie), voire de médicaments qui permettraient d’induire la régression de la malformation vasculaire
Ces recherches sur les formes familiales bénéficieront bien sûr aux personnes souffrant de cavernomes sporadiques.
En contactant les associations de malades consacrées à cette maladie. Vous trouverez leurs coordonnées en appelant Maladies Rares Info Services au 0 800 40 40 43 (numéro vert) ou sur le site Orphanet (www.orphanet.fr).
En France, certaines personnes atteintes de cavernomes cérébraux peuvent bénéficier d’une exonération du ticket modérateur, c’est-à-dire au remboursement à 100 % par la caisse de sécurité sociale des frais médicaux imputables à la maladie. Les personnes concernées par ces mesures sont celles présentant des cavernomes qui provoquent des troubles neurologiques nécessitant des traitements longs (durée prévisible supérieure à 6 mois) et particulièrement coûteux.
Pour les enfants, les familles peuvent obtenir une allocation d’éducation de l’enfant handicapé (AEEH), de même que les adultes ont la possibilité d’obtenir une allocation d’adulte handicapé en déposant un dossier auprès de la Maison Départementale des Personnes Handicapées (MDPH). Selon leur niveau de handicap, une allocation compensatrice pour tierce personne peut aussi être allouée aux malades. Enfin, une carte d’invalidité permet aux personnes handicapées dont le taux d’incapacité atteint ou dépasse 80 %, ce qui est rarement le cas pour le cavernome cérébral, de bénéficier de certains avantages fiscaux ou de transports. Une demande d’aide à domicile, si nécessaire, peut être faite auprès de la mairie ou d’une association de malades sur prescription du médecin.
Pour plus de précisions, vous pouvez consulter le cahier Orphanet « Vivre avec une maladie rare en France : aides et prestations » qui rassemble toutes les informations sur la législation en cours, les aides, les modalités de scolarisation et d’insertion professionnelle disponibles pour les personnes atteintes de maladies rares.

Président de l’association : Mr Christian Grandet
Siège social :
14, rue de Provence – 41100 Vendôme
Téléphone : 02 54 80 03 42
E-mail : cgrandet@wanadoo.fr
Site web : association-cavernome-cerebral.e-monsite.com
Pharmacien de formation et diplômée de l’ESSEC, Marion Pineau possède plus de 20 ans d’expérience en gestion de projet marketing et communication dans les domaines de la santé, prévention et bien-être. Son expertise couvre aussi bien la communication scientifique et institutionnelle que la coordination de projets impliquant médecins, patients et associations.
Au sein du CERVCO, elle pilote le développement des actions du centre, notamment l’organisation des Réunions de Concertation Pluridisciplinaires, les projets PNDS et le suivi des parcours de soins pour les maladies rares vasculaires du cerveau et de l’œil. Elle assure également le lien avec la plateforme d’expertise Paris Nord, la filière BRAIN-TEAM et le réseau européen VASCERN pour renforcer les synergies et favoriser l’innovation au bénéfice des patients.
Passionnée par la transmission et l’accessibilité de l’information en santé, elle contribue activement à la visibilité du CERVCO, notamment via son site internet, en veillant à rendre les contenus clairs et accessibles à tous les publics concernés (patients, professionnels de santé, associations).
D’abord secrétaire dans le secteur privé dés 1986, Solange Hello a intégré l’équipe du Service de Neurologie de l’hôpital Lariboisière en 2001. Elle a initialement exercé les fonctions de secrétaire de recherche et s’est investie dans le suivi de Projets Hospitaliers de Recherche Clinique concernant les maladies vasculaires cérébrales rares. Elle assure la fonction de secrétaire pour le CERVCO depuis le 1er janvier 2007.
Après l’obtention d’un doctorat en chimie de l’Université Claude Bernard Lyon I en 2005 et quelques années de recherche fondamentale Abbas Taleb a suivi une formation d’Attaché de Recherche Clinique (ARC) à l’institut Leonard De Vinci à Paris en 2010. Au décours de cette formation, il a intégré l’équipe du CERVCO et exerce actuellement la fonction de coordinateur d’essais cliniques. Il est responsable du recueil de données concernant les cohortes maladies rares.
Fanny Fernandes est docteur en Neurosciences. Après 15 ans de recherche préclinique en neurobiologie, sur les processus de myélinisation et de développement des glioblastomes, elle s’est tournée vers la recherche clinique en suivant les enseignements du DIU FIEC. Elle a ensuite animé le réseau national de recherche clinique FCRIN CRI-IMIDIATE sur les maladies auto-inflammatoires et auto-immunes puis le FHU ADAPT autour du développement de la médecine personnalisée en psychiatrie. Au sein du CERVCO elle anime le programme de recherche RHU Trt_cSVD qui a pour objectif de lutter contre les maladies des petits vaisseaux cérébraux en utilisant des approches pluridisciplinaires pour aboutir à des propositions innovantes pour la prise en charge des patients.
Diplômée d’un doctorat en pharmaco-oncologie, Estelle Dubus s’est d’abord intéressée à l’inhibition de l’angiogenèse dans les tumeurs pédiatriques comme cible thérapeutique et à la caractérisation des mécanismes de résistance associés. Au travers du programme de médecine personnalisée MAPPYACTS (#NCT02613962 ), elle a mis en place et coordonné un réseau national et européen de développement de modèles précliniques de tumeur pédiatrique en rechute. Après 15 ans en oncologie, elle a repris l’animation du DHU NeuroVasc et a structuré la recherche clinique au sein du département de neurologie. Aujourd’hui, chef de projet de la FHU NeuroVasc2030, elle anime le réseau neurovasculaire francilien dans le but de faire émerger de nouveaux projets : de la conception à la publication, coordination des équipes, animation des réseaux professionnels et veille au bon déroulement scientifique, réglementaire et budgétaire de chaque étape. Au sein du CERVCO, elle coordonne les essais cliniques et la remontée des données de file active, aide à la structuration des cohortes et bases de données, accompagne les collaborations et la réponse aux appels à projet.
Marie-Hélène De Sanctis est psychologue spécialisée en neuropsychologie au sein du service de Neurologie de l’Hôpital Lariboisière depuis 2017. Elle réalise des évaluations neuropsychologiques, anime des ateliers d’Éducation Thérapeutique du Patient et assure le suivi et le soutien psychologique des patients et de leurs proches. Elle intervient également au CERVCO pour l’évaluation neuropsychologique des patients atteints de maladies vasculaires rares du cerveau et de l’œil. Chargée de cours invitée à l’Université Paris 8, elle est également co-autrice d’une publication sur les manifestations insulaires en neuro-oncologie.
Sonia Reyes est psychologue à l’Assistance Publique. Elle a débuté son activité dans le Service de Neurologie du Pr. Bousser à l’hôpital Lariboisière et parallèlement au Centre de Neuropsychologie et du Langage dirigé par le Pr. Bruno Dubois à la Salpêtrière. Elle y a acquis une compétence particulière dans le dépistage de troubles cognitifs associés aux pathologies neurodégénératives et vasculaires du cerveau. Elle est actuellement psychologue au sein du département de neurologie de l’hôpital Lariboisière où elle prend en charge l’évaluation neuropsychologique des patients. Elle assure également la prise en charge psychologique de ces patients et de leur famille.
Au sein du CERVCO, elle assure l’évaluation neuropsychologique des patients, leur suivi, le soutien psychologique des patients et des familles. Enfin, elle participe des travaux de recherche clinique sur les troubles cognitifs au cours des pathologies neuro-vasculaires rares.
Aude Jabouley est psychologue à l’Assistance Publique depuis 9 ans. Elle a commencé à travailler en consultation mémoire dans les Hôpitaux Vaugirard-Gabriel Pallez et Paul Brousse. Elle y a acquis une compétence particulière dans le dépistage de troubles cognitifs associés aux pathologies neurodégénératives et vasculaires du cerveau. Depuis 7 ans et demi, elle est psychologue au sein du pôle « neuro sensoriel tête et cou » du Groupe Hospitalier Lariboisière-Fernand Widal où elle prend en charge l’évaluation neuropsychologique des patients. Elle assure également la prise en charge psychologique de ces patients et de leur famille.
Au sein du CERVCO, elle assure l’évaluation neuropsychologique des patients et leur suivi ainsi que le soutien psychologique des patients et des familles. Enfin, elle effectue actuellement des travaux de recherche clinique sur les troubles cognitifs au cours des pathologies neuro-vasculaires rares, en particulier la maladie de CADASIL.
Carla Machado est psychologue à l’Assistance Publique depuis 2012. Elle a commencé son activité clinique dans le service de Consultation Mémoire à l’hôpital Albert Chenevier où elle a développé une compétence dans l’évaluation des troubles cognitifs associés aux maladies neurodégénératives. Depuis, elle a rejoint l’équipe de psychologue dans le service de Neurologie du groupe hospitalier Lariboisière-Fernand Widal où elle prend en charge l’évaluation neuropsychologique des patients. Elle assure également la prise en charge psychologique de ces patients et de leur famille.
Au sein du CERVCO, elle assure les entretiens cliniques au sein des consultations multidisciplinaires pré symptomatique dans la maladie de CADASIL et participe aux consultations neurologiques dans le cadre de la remise des résultats génétiques. Elle participe également à des protocoles de recherche clinique sur les maladies neuro-vasculaires rares et est responsable du programme d’éducation thérapeutique du patient (ETP) pour l’angiopathie de moyamoya.
Le Professeur Homa Adle-Biassette est Chef du Service d’Anatomie et de Cytologie pathologique. Elle est Professeur d’Anatomie Pathologique. Elle est également membre de l’équipe INSERM 1141. Son intérêt principal est la neuropathologie et plus particulièrement le développement du système nerveux central. Elle a publié plus de 100 articles scientifiques dans le domaine de la neuropathologie.
Le Docteur Valérie Krivosic est ophtalmologiste, spécialisée dans les pathologies médicales et chirurgicales de la rétine. Après avoir réalisé un DEA dans l’unité INSERM dirigée par le professeur Tournier-Lasserve à l’université Paris VII, elle a été chef de clinique dans le service d’ophtalmologie dirigé par le professeur Gaudric à l’hôpital Lariboisière à Paris pendant 3 ans. Elle a ainsi acquis une compétence dans les pathologies de la vascularisation rétinienne tant sur le plan chirurgical (pour la rétinopathie diabétique par exemple) que sur le plan médical. Elle exerce actuellement son activité professionnelle à plein-temps à l’hôpital Lariboisière où elle se consacre à une activité chirurgicale et de recherche clinique sur les nouveaux médicaments de la rétine. Dans le cadre du CERVCO, elle prend en charge plusieurs affections des petits vaisseaux rétiniens telles que la vitréorétinopathie exsudative familiale, les télangiectasies maculaires idiopathiques ou la maladie de Von Hippel Lindau.
Ancien interne des hôpitaux de Paris, François NATAF a ensuite exercé la fonction de Chef de Clinique-Assistant des Hôpitaux puis de praticien hospitalier dans le service de neurochirurgie à l’hôpital Sainte-Anne à Paris de 1997 à 2022. Depuis 2022 il est praticien hospitalier dans le service de Neurochirurgie à l’hôpital Lariboisière à Paris.
Durant cette période, il a contribué au démarrage sur Paris et en France de l’activité de radiochirurgie, initialement et principalement sur les malformations artério-veineuses cérébrales. Il poursuit cette activité associée également à une activité chirurgicale au bloc opératoire.
Un équipement de radiochirurgie de dernière génération (ZAP-X) est en cours d’installation sur le site de l’hôpital Lariboisière. L’activité de radiochirurgie est une UF du service de Neurochirurgie de Lariboisière, sous la direction du Pr Hennequin, radiothérapeute à Saint-Louis. Cet équipement est l’aboutissement d’un projet du GHU Nord associant 7 services dans 3 hôpitaux (Lariboisière, Saint-Louis, Beaujon) en collaboration avec l’Institut de Radiothérapie Hartmann (dans le cadre d’un GCS). L’organisation médicale du GCS intègrera un conseil scientifique.
François NATAF est l’actuel Directeur médical du GCS de radiochirurgie. Les travaux en cours portent notamment sur la radiochirurgie des malformations vasculaires cérébrales (MAV et cavernomes).
Ancien interne des hôpitaux de Paris, le Docteur Anne-Laure Bernat est praticien hospitalier dans le service de Neurochirurgie de l’hôpital Lariboisière. Elle a réalisé un fellowship Clinique à Toronto au Canada. Au sein du département de neurochirurgie, elle prend en charge plus spécifiquement les maladies vasculaires neurochirurgicales, les méningiomes et les adénomes hypophysaires. Son activité de recherche scientifique en collaboration avec les équipes médicales intéressées porte essentiellement sur les maladies vasculaires neurochirurgicales et la gestion des patients victimes d’hémorragie méningée anévrismale. Dans le cadre du CERVCO, elle prend en charge les patients atteints d’anévrismes intra-crâniens, de malformations artério-veineuses et d’angiopathie de MOYA MOYA.
Le Professeur Sébastien Froelich est chef du service de Neurochirurgie de l’Hôpital Lariboisière. Ses travaux de recherche concernent plus particulièrement les affections de la base du crâne et certaines tumeurs comme le chordome. Dans le cadre du CERVCO, il prend plus particulièrement en charge les patients atteints de cavernomes cérébraux et d’angiopathie de moyamoya.
Ancien interne des hôpitaux de Paris et chef de clinique-assistant, Caroline Roos est neurologue, praticien hospitalier temps plein et responsable du Centre d’Urgences des Céphalées de l’hôpital Lariboisière. Elle s’est spécialisée dans la prise en charge des patients souffrant de céphalées primaires et secondaires Elle a participé à de nombreux travaux de recherche et fait partie du comité pédagogique du diplôme Inter-Universitaire Migraine et Céphalées. Dans le cadre du CERVCO, elle prend en charge les patients atteints d’ataxie épisodique et de migraine hémiplégique familiale ou sporadique. Elle est aussi référente pour la prise en charge des patients suivis dans le cadre du CERVCO, souffrant de céphalée.
Le Dr Vittorio Civelli est neuroradiologue interventionnel. Après une formation médicale et spécialisée à Milan (Italie) et un clinicat à l’hôpital Foch (Surennes) et à l’hôpital Lariboisière, il occupe depuis 2016 un poste permanent de Praticien Hospitalier dans le service de neuroradiologie interventionnelle dirigé par le Pr HOUDART où il se consacre à la prise en charge des pathologies vasculaires cérébrales et médullaires (anévrismes, fistules artério-veineuses, AVC, MAV), à la sclérose percutanée des angiomes et des anomalies vasculaires superficielles avec un intérêt clinique et de recherche principalement consacré au traitement de la pathologie sténosante veino-durale (traitement endovasculaire de l’acouphène pulsatiles et de l’hypertension intra-crânienne dite idiopathique), de l’hypotension du LCR, de la maladie de Moya-Moya et des malformations vasculaires superficielles.
Depuis 2014, le Dr Marc-Antoine Labeyrie est praticien hospitalier temps plein au sein du DMU neurosciences à l’hôpital Lariboisière. Il exerce la neuroradiologie interventionnelle et est spécialisé dans la prise en charge des pathologies artérielles et veineuses macrovasculaires de la tête, du cou et du rachis.
Au sein du CERVCO, il participe plus particulièrement aux RCP sur la maladie de Moyamoya et travaille sur le développement de nouvelles variables de phénotypage angiographique de cette maladie.
Ses autres thématiques de recherche sont : 1/ l’évaluation des techniques endovasculaires intracrâniennes innovantes (angioplastie de vasospasme, thrombectomie à la phase aigüe des AVC ischémiques, stenting des sinus latéraux dans l’hypertension intracrânienne idiopathique) ; 2/ L’épidémiologie des causes macrovasculaires rares d’ischémie cérébrale (carotid web, dissections artérielles cervicales et intracrâniennes) ; 3/ L’imagerie cérébrale quantitative (segmentation automatique de l’imagerie cérébrale à la phase aigüe des hémorragies sous arachnoïdiennes).
Professeur des Universités – Praticien Hospitalier, responsable de l’unité de Neuroradiologie Interventionnelle du Service de Neuroradiologie depuis 1997. Cette unité effectue annuellement 800 artériographies cérébrales et 500 interventions endovasculaires de la sphère cérébrale, ORL et médullaire par année. Il s’agit d’un des centres français ayant l’activité la plus importante dans ce domaine. L’activité clinique est supportée par une activité de recherche centrée sur l’évaluation des nouvelles techniques de traitement des anévrysmes intracrâniens, des malformations artério-veineuses cérébrales et de l’athérome des artères cérébrales.
Ancien Interne des hôpitaux de Paris, il a été Assistant Hospitalier Universitaire dans le service de Neurologie de l’hôpital Bichat et Chef de Clinique-Assistant dans le service de Neuroradiologie de l’hôpital Lariboisière. Il est Professeur de Neurologie à l’Université Denis Diderot depuis 2013, membre de l’Unité INSERM 1148 (Laboratory of Vascular Translational Science) et chef du département de Neurologie de l’hôpital Lariboisière. Il partage ses activités de soins entre la neurologie et la neuroradiologie interventionnelle pour la prise en charge des accidents vasculaires cérébraux et notamment des malformations vasculaires cérébrales. Ses travaux de recherche sont centrés sur le développement et l’évaluation de nouveaux traitements à la phase aigüe de l’accident vasculaire cérébral. Pr Mazighi est aussi dans la gouvernance de la FHU Neurovasc 2030, leader du work package 0.
Après un DES de Neurologie à Paris, Isabelle Crassard a effectué un clinicat à l’hôpital Lariboisière (Services de Neurologie et d’Angiohématologie). Elle est actuellement praticien hospitalier dans le département de neurologie de l’hôpital Lariboisière. Elle s’intéresse en particulier aux troubles de la coagulation à l’origine de certains accidents vasculaires cérébraux et aux maladies veineuses cérébrales. Dans le cadre du Centre Maladies Rares, elle prend plus particulièrement en charge les patients ayant une thrombose veineuse cérébrale.
Eric Jouvent est ancien interne et ancien Chef de Clinique – Assistant des hôpitaux de Paris. Il est Professeur des Universités en neurologie à l’Université Paris Diderot et Praticien Hospitalier dans le service de neurologie de l’hôpital Lariboisière. Il s’intéresse à la pathologie vasculaire cérébrale, notamment aux aspects cognitifs et comportementaux des maladies des petites artères cérébrales dont CADASIL.
Ses travaux de recherche portent sur les liens entre l’imagerie et les aspects cliniques dans les maladies des petites artères cérébrales et dans CADASIL, et en particulier sur le rôle du cortex cérébral.
Membre du comité exécutif de la FHU Neurovas2030, Pr Jouvent a un intérêt pour l’innovation et les nouvelles technologies en particulier autour de l’imagerie cérébrale.
Le Docteur Stéphanie Guey, Neurologue, ancien interne des Hôpitaux de Paris et titulaire d’une thèse de sciences en Génétique, est depuis septembre 2022 Maître de Conférences des Universités – Praticien Hospitalier (MCU-PH) au sein du centre de neurologie translationnel (CNVT) Lariboisière et de l’Université Paris Cité.
Au sein du CERVCO, (centre de référence dédié aux maladies vasculaires rares du cerveau et de l’œil), elle consacre son activité clinique et de recherche aux affections cérébrovasculaires rares de l’adulte et plus particulièrement les cavernomatoses cérébrales et les maladies vasculaires cérébrales d’origine génétique, en particulier celles liées aux anomalies des gènes COL4A1 et COL4A2.
Dr Guey a développé une expertise reconnue dans le diagnostic, la compréhension et le suivi de ces pathologies encore peu connues. Elle s’attache à améliorer le parcours de soins des patients et à favoriser le dialogue entre la recherche, les équipes médicales et les familles.
Membre du Conseil scientifique de l’Association COL4A1-A2, Dr Guey est engagée dans une collaboration étroite avec les représentants des patients pour favoriser la diffusion des connaissances, accompagner les familles et faire progresser la recherche dans une approche humaine et collective.
Le Professeur Dominique HERVE a initialement exercé la fonction de Chef de Clinique – Assistant des Hôpitaux au sein du service de neurologie vasculaire de l’hôpital Lariboisière dédiée à la prise en charge en phase aigüe des pathologies vasculaires cérébrales. Depuis Novembre 2006, Dominique HERVE est Praticien Hospitalier temps plein à Lariboisière et son activité clinique est centrée sur la prise en charge des maladies cérébrovasculaires rares. Il est Professeur Associé de Neurologie à l’Université Paris Cité depuis septembre 2025.
Au sein du Centre Neuro-Vasculaire Translationnel (CNVT) de l’hôpital Lariboisière, il est le responsable médical du Centre de Référence des maladies Vasculaires rares du Cerveau et de l’Oeil (CERVCO). Sa mission est pleinement dédiée au développement de ce centre de référence. Dans le cadre du CERVCO, son activité clinique et de recherche concerne principalement l’angiopathie de Moyamoya et les maladies génétiques des petites artères cérébrales (CADASIL et autres leucoencéphalopathies vasculaires génétiques). Il a récemment coordonné la rédaction de recommandations européennes concernant la prise en charge de l’angiopathie de Moyamoya sous l’égide de l’European Stroke Organisation (ESO). Il prend également en charge les patients atteints de cavernomatoses cérébrales et de forme familiale d’anévrysmes cérébraux.
Depuis 2022, il coordonne un groupe de travail européen dédié aux maladies cérébrovasculaires rares (NEUROVASC) au sein du réseau européen de référence pour les maladies vasculaires rares (VASCERN).
Le Professeur Hugues Chabriat est coordonnateur du centre de référence pour les maladies vasculaires rares du cerveau et de l’oeil (CERVCO). Ancien interne des hopitaux d’Ile de France (Cochin Port-Royal) et chef de clinique à la faculté de médecine de Saint-Antoine à Paris, il est professeur de neurologie à l’Université Denis Diderot (Paris VII), chef de service du Centre Neuro-vasculaire Translationnel (CNVT) à l’Hôpital Lariboisiere et co-responsable d’une équipe de recherche au sein de l’unité INSERM U1141.
Ses travaux de recherche concernent plus particulièrement les affections vasculaires rares des petits vaisseaux du cerveau, l’imagerie cérébrale des maladies artériolaires cérébrales et les troubles cognitifs d’origine vasculaire. Il participe avec l’équipe de génétique à l’étude de nouvelles familles de leucoencéphalopathies vasculaire dont l’origine reste à déterminer. Il développe avec d’autres chercheurs les outils d’imagerie pour évaluer, en particulier, l’évolution et les futures thérapeutiques de ces affections.
Il a publié plus d’une centaine d’articles ou de chapitres de livre consacrées aux leucoencéphalopathies vasculaires, à l’imagerie cérébrale des maladies des petits vaisseaux du cerveau et à CADASIL.